Подсчет эритроцитов в камере Горяева: формула с примером
Камера Горяева – оптическое приспособление, необходимое для вычисления количества клеток в биологических жидкостях человека. Устройство применяется во всех медицинских учреждениях. За ним необходим тщательный уход, чтобы подсчет эритроцитов в камере Горяева был достоверен. Метод достаточно информативен, удобен для врачей-лаборантов.
Приспособление представлено толстым стеклом, в котором расположены углубления. Они необходимы для залития биологической жидкости человека. Сверху помещается тонкое предметное стекло, которое способствует устранению пузырьков воздуха и распределению биологической жидкости по углублению.
Устройство позволяет подсчитывать количество лейкоцитов и эритроцитов с помощью микроскопа, направленного на углубление. Полученные данные подставляют в формулу, чтобы выявить число клеток в заданном объеме жидкости.
Под микроскопом врач-лаборант видит большие и малые квадраты, которые в сумме составляют 225. За одно исследование необходимо подсчитать клетки в 100 квадратах.
Обслуживание и уход за камерой Горяева
Чтобы приспособление выполняло свои функции, врач-лаборант правильно подсчитал форменные элементы, за ним необходимо ухаживать. Оно должно быть всегда чистым, стерильным. Наличие инородных предметов затруднит исследование.
В ходе работы при подсчете эритроцитов в камере Горяева выполняют следующие дезинфицирующие манипуляции:
- с помощью марлевой салфетки, опущенной в спиртовой раствор, протирают все углубления камеры;
- сухой марлевой салфеткой повторно протирают поверхность;
- приспособление готово к работе, если с обеих его сторон появились радужные круги.
После окончания работы устройство дезинфицируют повторно:
- биологическую жидкость удаляют;
- камеру помещают в спиртовой раствор на полчаса, если используются другие дезинфектанты, время удлиняют до 60 минут;
- приспособление достают, протирают насухо до появления радужных кругов;
- стекло оставляют на сухой поверхности.
Алгоритмы подсчета эритроцитов в камере Горяева
Получают капиллярную кровь с помощью прокола скарификатором подушечки пальца. Важно, чтобы первая капля не попала в капилляр, так как в ней содержится тканевая жидкость и поврежденные эритроциты. Собирают кровь в капилляр.
Далее проводят манипуляция для проведения исследования с помощью камеры Горяева.
- Кровь необходимо развести в 200 раз. Для этого используют раствор хлорида натрия.
- Камеру подготавливают для проведения анализа, протирая её спиртовым раствором и сухой марлевой салфеткой. Нельзя использовать для этих целей вату, так как ее волокна могут остаться на стекле, что затруднит проведение анализа.
- Покровное стекло ставится сверху камеры. Делают это аккуратно, чтобы оно точно встало в пазы.
- Стеклянной палочкой берут немного образца биологической жидкости и подносят к отверстиям углублений. Кровь должна медленно распределиться по камере. Выжидают 1-2 минуты, чтобы исчезли пузырьки.
- Микроскоп ставят на малое увеличение и подсчитывают количество эритроцитов в 80 малых квадратах сетки.
- Полученное число подставляют формулу, рассчитывая количество красных кровяных телец на заданный объем биологической жидкости.
Метод является достаточно информативным, но возможны погрешности. Врач может ошибиться в подсчетах с помощью микроскопа, или взять объём жидкости, в котором находится недостаточно эритроцитов.
Поэтому при появлении погрешностей или не точных результатов терапевт может назначить повторные исследования на полуавтоматическом анализаторе, который подсчитывает точное количество форменных элементов в 1 мл жидкости.
Достоинством метода является то, что врач может обнаружить другие образования помимо эритроцитов, что поможет выявить нарушения в организме.
Формула подсчета количества эритроцитов в камере Горяева
После получения количества красных кровяных телец, число необходимо подставить в формулу. С ее помощью подсчитывается число красных кровяных телец на заданный объем биологической жидкости.
X=(E×4000×200)/80
- X – количество эритроцитов в заданном объеме биологической жидкости;
- E – сумма эритроцитов, выявленная под микроскопом;
- 200 – разведение крови;
- 80 – число маленьких квадратов, в которых считали клетки.
Чтобы пересчитать эритроциты на 1 л крови, полученный результат умножают на 1012.
Норма эритроцитов и отклонения
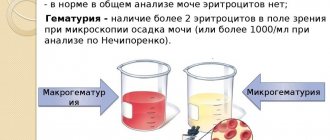
В норме количество эритроцитов отличается по полу и возрасту двоеточие
- мужчины 3,8-5×1012;
- женщины 4-4,5×1012;
- дети 5,5-7×1012.
Количество эритроцитов может быть повышено или снижено. Существуют физиологические причины изменения. Например, у женщины во время менструации количество эритроцитов снижено, так как теряется некоторый объём биологической жидкости.
Патологические причины повышения эритроцитов:
- обезвоживание, вследствие чего уменьшается количество плазмы крови, число форменных элементов увеличивается;
- рак крови, почек, желез внутренней секреции, изменяющих гормональный баланс в организме;
- недостаток кислорода в крови, вследствие чего красный костный мозг излишне образует эритроциты.
Патологические причины снижения эритроцитов:
- большая кровопотеря;
- периодические кровопотери в следствии небольших кровотечений из слизистых оболочек ЖКТ;
- алиментарный фактор (употребление пищи с малым количеством полезных веществ, микроэлементов, минералов);
- нарушение всасывания веществ в кишечнике;
- повышенное содержание плазмы крови;
- разрушение красных кровяных телец в следствие переливания крови, отравления;
- хронический алкоголизм, который ухудшает работу почек и красного костного мозга, вследствие чего образуется малое число ретикулоцитов (предшественники эритроцитов).
С помощью камеры Горяева подсчитывают число эритроцитов. Важно знать, что бывают более информативные методы исследования, которые позволяют исключить риск врачебной ошибки.
Приспособление работает точно, если соблюдаются методы его дезинфекции, врач тщательно пересчитывает все клетки.
После получения результата анализов необходимо обратиться к врачу, самостоятельно поставить диагноз невозможно.
Читайте подробный обзор всех методик подсчета количества эритроцитов от врача.
Екатерина Беликова, врач лабораторной диагностики, специально для Mirmam.pro
Источник: https://mirmam.pro/podschet-eritrotsitov-v-kamere-goryaeva
Взятие крови и подсчет эритроцитов и лейкоцитов в счетной камере
Для проведения данных исследований необходимо следующее оснащение рабочего места:
- Смесители для эритроцитов и лейкоцитов.
- Пробирки типа серологических.
- Пипетки на 1 и 5 мл.
- Капилляры к гемометру Сали.
- Стеклянные палочки.
- Глазные пипетки.
- Счетные камеры Горяева со шлифованными стеклами к ним.
- Микроскопы.
- Колбочки с чистой водой.
- Поваренная соль.
- Сулема.
- Сернокислый натрий.
- Ледяная уксусная кислота.
- 96° этиловый спирт.
- Генцианвиолет (метиленовая синька).
- Набор для взятия крови из пальца.
Взятие крови в смесители для подсчета эритроцитов и лейкоцитов
Для подсчета количества эритроцитов и лейкоцитов необходимы следующие реактивы:
- 3% раствор хлористого натрия (NaCl) : 3 г хлористого натрия помещают в колбочку на 100 мл и доливают дистиллированной водой до метки 100 мл.
- Реактив Гайема: к 0,5 г сулемы, 1 г хлористого и 5 г сернокислого натрия приливают 200 мл дистиллированной воды. Оба реактива сохраняют эритроциты.
- 3% раствор уксусной кислоты – 3 мл ледяной уксусной кислоты помещают в цилиндр на 100 мл и доливают дистиллированной водой до метки. Реактив подкрашивают 1% водным раствором генцианвиолета из расчета 5-6 капель краски на 10 мл 3% уксусной кислоты.
Кровь для подсчета эритроцитов и лейкоцитов берут в специальные смесители или в пробирки.
На чистый и сухой смеситель для эритроцитов надевают резиновую трубочку со стеклянным мундштуком, после чего в него насасывают кровь, без пузырьков воздуха, точно до метки 0,5, затем этим же смесителем набирают 3% раствор хлористого натрия или реактив Гайема точно до метки 101, не допуская появления пузырьков воздуха.
При этом кровь разводится в 200 раз. Со смесителя снимают резиновую трубочку, захватывают его между пальцами, несколько раз встряхивают, прокалывают им бумажку, на которой указана фамилия больного, и кладут его на стол в горизонтальном положении.
В чистый сухой смеситель для лейкоцитов таким же способом, как и в смеситель для эритроцитов, насасывают кровь до метки 0,5, после чего тем же смесителем набирают 3% раствор уксусной кислоты до метки 11.
При этом кровь разводится в 20 раз.
Затем со смесителя снимают резиновую трубочку, несколько раз встряхивают его, прокалывают им бумажку, на которой указана фамилия больного, и кладут на стол в горизонтальном положении.
Взятие крови в пробирки для подсчета эритроцитов и лейкоцитов по Н. М. Николаеву
Для каждого взятия крови берут две нумерованные пробирки, серологическую и агглютинационную. В серологическую пробирку помещают 4 мл 3% раствора хлористого натрия или реактива Гайема, а в агглютинационную – 0,4 мл 3 % раствора уксусной кислоты. В каждую пробирку вносят по 0,02 мл крови, взятой капилляром от гемометра, и тотчас же смешивают содержимое пробирок, вращая их между ладонями.
В серологической пробирке (для эритроцитов) получают разведение крови в 200 раз, а в агглютинационной (для лейкоцитов) – в 20 раз.
Изучение счетной камеры Горяева и заполнение ее кровью для подсчета эритроцитов и лейкоцитов
Количество эритроцитов и лейкоцитов подсчитывают в специальных счетных камерах. Для этой цели пользуются счетной камерой Горяева, которая представляет собой стекло с нанесенными на него двумя сетками.
Сетки отделены одна от другой углублениями и делятся разграничительными линиями на 225 квадратов. Площадь сетки 9 мм2, высота, создающаяся при притирании шлифованного покровного стекла в камере, 0,1 мм, объем 0,9 мм3.
Перед заполнением камеры кровью ее моют водой и насухо вытирают.
К сухой поверхности камеры притирают шлифованное покровное стекло, плавно продвигая его по ней взад и вперед до появления цветных колец Ньютона в местах соприкосновения покровного стекла со стеклом камеры.
Затем кровь в смесителе встряхивают в течение 1-2 минут, после чего из смесителя выпускают на ватку 1-2 капли крови, следующую каплю помещают перед шлифованным покровным стеклом.
При нанесении капли крови надо следить за тем, чтобы в пространство над сеткой камеры не попал воздух и чтобы не было избытка жидкости. Одну сетку заполняют для подсчета эритроцитов, вторую – для подсчета лейкоцитов.
Для заполнения камеры Горяева кровью, взятой по способу Н. М. Николаева (пробирочный метод), поступают следующим образом. К счетной камере притирают шлифованное стекло.
Из каждой пробирки, предварительно встряхнув ее, с помощью стеклянной палочки с оплавленным концом берут по одной капле жидкости и заполняют ими раздельно обе сетки камеры, для чего каплю помещают перед щелью, образующейся между шлифованным стеклом и счетной камерой, в результате чего жидкость заполняет пространство над сетками.
Подсчёт эритроцитов и лейкоцитов в счетной камере Горяева
Количество эритроцитов и лейкоцитов в камере Горяева подсчитывают с помощью микроскопа. Для этого заполненную разведенной кровью камеру Горяева помещают на предметный столик микроскопа и под малым увеличением (окуляр 15 X или 10Х, объектив 8Х), с опущенным конденсором находят сетку камеры. К подсчету форменных элементов приступают через 2-3 минуты после заполнения камеры кровью.
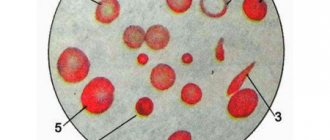
Эритроциты подсчитывают в пяти квадратах, каждый из которых разделен на 16 маленьких квадратиков. Подсчет начинают с левого верхнего квадрата, а затем продвигают камеру по диагонали сверху вниз.
Во избежание повторного подсчета одних и тех же эритроцитов руководствуются следующим правилом: все эритроциты внутри квадратика и на разграничительных линиях подсчитывают только тогда, когда они большей своей половиной заходят внутрь квадратика; клетки, пересеченные разграничительной чертой пополам, подсчитывают лишь на двух сторонах из четырех сторон квадрата (на левой и верхней); клетки, выходящие большей своей половиной за пределы разграничительных линий, совсем не считают. Результаты подсчета эритроцитов по каждому из пяти больших квадратов записывают и суммируют. Для расчета количества эритроцитов пользуются следующей формулой:
где х — количество эритроцитов в 1 мм3 крови; а — сумма эритроцитов, подсчитанных в пяти квадратах; б — разведение крови в 200 раз; в — количество сосчитанных маленьких квадратиков — 80.
Для упрощения расчета к количеству подсчитанных эритроцитов приписывают четыре нуля.В норме количество эритроцитов от 4 500 000 до 5 000 000 в 1 мм3 крови. Лейкоциты подсчитывают в 100 больших квадратах.
При подсчете их руководствуются теми же правилами, которые указаны для эритроцитов, а затем производят расчет по приведенной выше формуле, в которой цифра разведения равна 20, а количество подсчитанных квадратов — 1600.
Для простоты расчета количество подсчитанных лейкоцитов умножают на 50 или делят на 2 и приписывают два пуля.
В норме количество лейкоцитов от 5000 до 8000 в 1 мм3 крови.
Источник: https://ginekolog.my1.ru/publ/klinicheskie_issledovanija/blood/podschet_ehritrocitov_i_lejkocitov_v_schetnoj_kamere/39-1-0-756
Подсчет лейкоцитов и эритроцитов в камере Горяева (методика)
Камера Горяева
Камера Горяева представляет из себя простое устройство для визуального подсчета форменных элементов крови под микроскопическим увеличением. Оно сконструировано на основе предметного стекла, имеющего специальные углубления для номинального объема крови, а также покровного стекла с нанесенной сеткой.
Различают несколько конструкций камеры Горяева в зависимости от количества камер (углублений для заполнения кровью), чаще всего в лабораториях применяются двухкамерные или четырехкамерные модели. Над каждой из камер находится специальная счетная сетка, нанесенная на покровное стекло методом лазерной гравировки либо при помощи микронапыления краски.
Приспособление сконструировано таким образом, что все имеющиеся камеры имеют равный объем, который указан в технической документации модели, их глубина и размеры секторов покровной сетки также стандартны. Это делает возможным переводить после подсчета форменных элементов их суммарные значения в единицы концентрации заданных клеток в объеме крови.
Описание сетки камеры Горяева
Сетка в камере Горяева
Покровное стекло имеет гравировку в виде сетки, большие квадраты которой имеют величину стороны в 1 мм. Чаще всего таких квадратов 9 над каждой счетной камерой, они расположены так, что образуют три столбца по три квадрата в каждом.
Те большие квадраты, что располагаются по периферии, разделены на 16 квадратов поменьше, длина и ширина которых равны 0,2 мм.
Стандартная глубина камеры под этими квадратами позволяет легко подсчитывать количество клеток в единицах объема, он равен для них 0,1 мм3 или 10-4 мл.
Большой квадрат, расположенный посередине, имеет дополнительные разделяющие линии, они нанесены так, что делят каждый из 16 средних квадратов еще на 16 самых маленьких. Их сторона равна 0,05 мм.
Правило Егорова для подсчета форменных элементов
Правильный подсчет клеток в сетке
Подсчет форменных элементов крови ведется под микроскопом с применением соответствующего увеличения, чаще всего используется окуляр х10. Подсчитывают число клеток в тех больших квадратах, что разделены на 16 средних, начинают считать от верхнего левого и двигаются вниз направо, захватывая при подсчете 5 больших квадратов.
Для того, чтобы верно определить количество клеток в заданном объеме крови, необходимо исключить повторный подсчет тех форменных элементов, что располагаются на границах или узлах сетки.
Такая ошибка привела бы к увеличению подсчитываемого показателя, для ее устранения было сформулировано правило Егорова.
Оно гласит, что к данному квадрату относятся те элементы, что лежат в его пределах, не касаясь нанесенных линий, а также те клетки, что располагаются на верхней и левой сторонах квадрата. Те клетки, что «касаются» нижней или правой стороны, при подсчете учитываться не должны.
Методика подсчета лейкоцитов
При ошибке анализатора помогает камера Горяева
Для подсчета лейкоцитов в крови в современных клинических лабораториях чаще всего используются специальные автоматические анализаторы, методика подсчета при помощи камеры Горяева относится к редко применяемым из-за своей трудоемкости и низкой скорости анализа. Для того, чтобы верно определить концентрацию отдельных видов лейкоцитов, требуется врач лабораторной диагностики или фельдшер-лаборант, владеющий навыками работы с микроскопом.
Подсчет при помощи камеры Горяева оправдан в тех случаях, когда автоматический анализатор не способен верно идентифицировать клетки крови пациента.
Это случается при онкологических заболеваниях системы крови и некоторых других болезнях, при которых клетки имеют нетипичный вид и объем.
К плюсам визуального подсчета относится возможность углубленной диагностики благодаря тому, что опытный врач способен отличить измененные клетки, характерные для отдельных патологий, и отразить их наличие в результатах анализа.
Лейкоциты должны быть подготовленными перед работой
Для подсчета отдельных видов лейкоцитов кровь разводят в несколько раз слабым раствором уксусной кислоты, при этом образцы без лейкоцитоза, как правило, следует разводить не менее чем в 20 раз, в случаях выраженного увеличения количества белых кровяных телец может потребоваться большее разведение. Для контрастирования изображения применяют окрашивание метиленовой синью.
После заполнения камер исследуемым объемом крови сверху накладывается покровное стекло сеткой и производится ее притирка, в ходе которой должны полностью исчезнуть пузыри воздуха между двумя стеклами. Заполненная камера помещается под микроскоп, причем целесообразно оставить ее неподвижной на 1-2 минуты для того, чтобы форменные элементы полностью прекратили движение и осели.
После этого на среднем увеличении (окуляр не менее чем х10) проводится подсчет отдельных видов лейкоцитов в не менее чем 100 квадратах.
Для перевода получившегося числа в объемные значения необходимо умножить его на разведение (как правило, в 20 раз) и на количество квадратов, участвовавших в подсчете (чаще всего 100).
Полученное число дает представление о количестве лейкоцитов в 1 мкл крови.
Методика подсчета эритроцитов
Соблюдение алгоритма позволяет произвести точный подсчет клеток
Исследуемую кровь разводят при помощи физиологического раствора минимум в 100 раз для того, чтобы стал возможен визуальный подсчет красных кровяных телец. При недостаточном разведении в камерах образуется двойной слой форменных элементов крови, что делает невозможным их определение.
После наложения покровного стекла и притирки проводят микроскопирование препарата при увеличении окуляром х10. Подсчет ведется во всех 5 больших квадратах, разделенных линиями на 16 секторов.
Расчет объемных значений проводят при помощи умножения полученного числа эритроцитов на степень разведения (чаще в 100 или 200 раз) и на 4000, затем проводят деление полученного числа на 80 (количество малых квадратов при подсчете). Полученное число характеризует количество эритроцитов в 1 мкл крови.
Источник: https://gidanaliz.ru/poznavatelno/podschet-v-kamere-gorjaeva.html
Правило Егорова для подсчета форменных элементов
Правильный подсчет клеток в сетке
Подсчет форменных элементов крови ведется под микроскопом с применением соответствующего увеличения, чаще всего используется окуляр х10. Подсчитывают число клеток в тех больших квадратах, что разделены на 16 средних, начинают считать от верхнего левого и двигаются вниз направо, захватывая при подсчете 5 больших квадратов.
Для того, чтобы верно определить количество клеток в заданном объеме крови, необходимо исключить повторный подсчет тех форменных элементов, что располагаются на границах или узлах сетки. Такая ошибка привела бы к увеличению подсчитываемого показателя, для ее устранения было сформулировано правило Егорова. Оно гласит, что к данному квадрату относятся те элементы, что лежат в его пределах, не касаясь нанесенных линий, а также те клетки, что располагаются на верхней и левой сторонах квадрата. Те клетки, что «касаются» нижней или правой стороны, при подсчете учитываться не должны.
Подсчет эритроцитов в камере Горяева — каким образом происходит вычисление уровня эритроцитов?
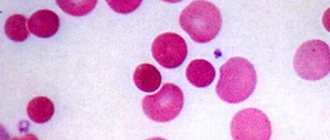
Состав крови образован плазмой и форменными компонентами, большую часть из которых составляют эритроциты. Зрелые кровяные клетки не содержат ядра и имеют двояковогнутую форму.
их функция – транспортировка газов в тканях органов.
Уровень эритроцитарных клеток в крови человека зависим от таких факторов, как пол и возраст, но является величиной достаточно постоянной, поэтому колебание их количества дает ценную информацию в процессе диагностирования.
Для вычисления количества кровяных клеток чаще всего используется унифицированный метод подсчета эритроцитов с использованием оборудования, известного, как камера Горяева, либо с помощью электронных счетчиков автоматического типа. Оба способа на данный момент широко используются и в ежедневной лабораторной практике, и при научных изысканиях, так как погрешность результатов, полученных в ходе их применения, минимальна.
Строение камеры Горяева
Оптическое устройство – камера Горяева позволяет вычислить количество кровяных клеток в определенном объёме специальной жидкости. Идея создания устройства принадлежит русскому профессору Горяеву Н. К.
Главный элемент устройства – прозрачное предметное стекло с камерой, образованной углублением в форме прямоугольника, поверхность которой покрыта специальной микроскопической сеткой, и тонкое покровное стекло. Высокая точность результатов подсчета достигается благодаря повышенному объёму сетки в сравнении с аналогичными устройствами других типов.
Сетка устройства имеет площадь 9 мм2, размер одной стороны составляет 3 мм. Поверхность данного элемента образована квадратами общим числом в 225 шт. Из них одна сотня квадратов поделена на прямоугольники, еще столько же – не разграфлено, а 25 штук поделены на 16 более маленьких. Площадь 1 малого квадрата составляет 1/400 мм2, область над ним имеет объём 1/4000 мм3.
Разбавление крови с целью исследования
Определение количества эритроцитов состоит из нескольких последовательных действий. Первым этапом становится разведение определенного объёма крови в реагенте. Делается это в связи с огромным числом форменных элементов.
В качестве реагента чаще всего выступает раствор хлорида натрия концентрацией 0,9%. При необходимости альтернативой служит 5% раствор натрия цитрата. Процедуру разбавления крови выполняют в пробирке или в специальном смесителе, называемом меланжером.
Внимание! Использование растворов с более высокой или низкой концентрацией исключено, так как повлечет за собой разрушение кровяных клеток.
Разбавление крови в меланжере
Меланжером называется изготовленный из стекла градуированный капилляр длинной 10 см с расширением на конце, внутри которого расположен шарик. Последний выполняет важную функцию – равномерное смешивание раствора и крови. Цвет шарика меланжерного капилляра будет красным, если он предназначен для эритроцитов, и белым – для работы с лейкоцитами.
Методика подсчета эритроцитов позволяет проводить процедуру исследования и со стабилизированной кровью, и с нестабилизированным материалом сразу после его забора у пациента.
Кровь набирают меланжерным капилляром до деления 0,5, после чего кончик смесителя очищают от крови с помощью марли либо ватки и следующим действием набирают разбавляющий раствор до деления 101.
Перекрыв пальцами отверстия капилляра, полученный образец тщательно смешивают около 3 минут. В счётную камеру помещают четвёртую каплю, предварительно удалив первые три на марлю.
Таким образом получают разбавление крови в 200 раз.
Разбавление крови в пробирке
При пробирочном методе разбавления крови исследуемый материал разводят в 200 раз следующим образом: 4 мл раствора хлорида натрия помещают в пробирку, после чего добавляют 0,02 мл крови.
Для этого забор материала производят пипеткой, кончик которой протирают ваткой или другой тканью. Образец крови помещают на дно пробирки, пипетку промывают ближе к поверхности раствором хлорида натрия. Готовый образец перемешивают и оставляют до дальнейшего этапа исследования, но менее чем на 3 часа.
Подсчет количества эритроцитов
Камера Горяева обязательно располагается горизонтально. Всю площадь сетки аккуратно заполняют разведенным образцом. Важно проследить, чтобы не образовались пузырьки воздуха, ведь их наличие значительно исказит результат. В таком положении камера остается в течение одной минуты с целью оседания кровяных клеток.
Унифицированный метод подсчета эритроцитов проходит при среднем увеличении посредством микроскопического осмотра. Подсчет числа эритроцитов в камере Горяева ведут в 5 больших квадратах, поделенных на 16 малых.
Начало отсчета рекомендовано производить с большого квадрата, находящегося вверху слева, и далее по диагонали.
Важно! Чтобы количество клеток, находящихся на линиях малых квадратов, не было подсчитано дважды, рекомендуют пользоваться правилом Егорова: в каждом квадрате вести подсчет по двум определенным линиям (верхней и левой).
Начинают высчитывание клеток в малых квадратах в верхнем ряду слева направо от 1-го до 4-го в этом ряду. Переходя к следующему ряду, подсчет ведут в обратном порядке – справа налево. Переход к подсчету клеток в следующем большом квадрате производят после вычисления эритроцитов в этих 16 малых квадратах.
Непосредственно расчет числа эритроцитов ведут по формуле, отображенной на рисунке №2.
Обозначения в данной формуле расшифровываются следующим образом:
- X – искомое число красных кровяных клеток в 1 мкл крови,
- A обозначает количество сосчитанных клеток,
- 200 – разбавление крови,
- 80 – это количество малых посчитанных квадратов,
- 1/4000 – объем маленького квадрата.
Внимание! Для достоверности результата расчет кровяных клеток при некоторых видах анемии необходимо проводить непосредственно после забора материала.
Возможные причины искажения результата
Как и любой другой лабораторный анализ, подсчет эритроцитов требует тщательной подготовки и аккуратности в исполнении. Искажение результатов анализа может возникнуть вследствие целого ряда причин. Оборудование хранят в сухом месте. Любая лабораторная работа, связанная с кровью, выполняется в резиновых перчатках.
Для начала следует убедиться в правильности подготовки и использования камеры. Перед работой и по ее окончании устройство необходимо тщательно промывать дистиллированной водой и насухо протирать мягкой тканью. Покровное стекло должно быть подготовлено заблаговременно таким же образом.
Возможные причины, влияющие на достоверность результата:
- Некачественные реактивы, способные вызывать гемолиз.
- Формирование сгустка крови в материале.
- Неаккуратность в процессе забора крови в капилляр.
- Плохо обработанные пробирки и пипетки.
- Недобросовестная техника исполнения при работе с камерой и подсчете эритроцитов.
- Высчитывание клеток сразу же после заполнения камеры (необходимо выждать 1 минуту, чтобы они успели осесть на поверхность).
В последнее время все большую популярность получает метод подсчета эритроцитов с использованием электронных счетчиков автоматического типа. Такая тенденция вполне обоснованна, так как автоматизированный процесс исследования значительно точнее и менее трудоёмок.
Принцип действия данного оборудования основан на разном показателе электропроводности клеток крови и раствора, в котором они помещены. Специальное электромагнитное устройство регистрирует изменение уровня сопротивления электрической цепи, когда эритроциты движутся через отверстие капилляра. Уже через несколько секунд на цифровом табло высвечивается результат с высчитанным числом клеток.
Повышенный показатель красных кровяных клеток в анализе называется полицитемией. Данное состояние возникает вследствие патологий, характеризующихся потерей жидкости в организме, например при диарейном синдроме.
Часто такое явление наблюдается на первых этапах инфекционных заболеваний, при отравлении токсичными веществами и прочем. Снижение же концентрации эритроцитов в крови известно как олигоцитемия.
И зачастую такая патология проявляется во время различного вида анемии.
Загрузка…
Источник: https://dlja-pohudenija.ru/serdcze/metod-podscheta-kolichestva-eritroczitov-v-krovi-s-pomoshhyu-kamery-goryaeva
Подсчет количества эритроцитов и клиническая оценка результатов
Эритроциты, также как лейкоциты и тромбоциты относятся к форменным элементам крови. Подсчет их количества проводят при общем клиническом анализе крови наряду с оценкой СОЭ, определением концентрации гемоглобина, выведением лейкограммы и расчетом индексов красной крови, к которым относят цветовой показатель (ЦП) и содержание гемоглобина в одном эритроците (СГЭ).
Эритроциты — самые многочисленные форменные элементы крови, которые содержат гемоглобин. Следовательно, их основная функция в организме — осуществление газообмена. С помощью гемоглобина эритроциты переносят кислород и углекислоту. Кроме того, эритроциты доставляют клеткам аминокислоты и липиды, принимают участие в регуляции кислотно-щелочного равновесия, выполняют защитную и другие жизненно важные функции, которые более подробно рассматривали в курсе физиологии.
Содержание эритроцитов в крови здоровых животных и птицы довольно постоянное, поэтому установление изменения их количества имеет диагностическое значение. Правда, колебания их числа можно наблюдать в зависимости от времени суток исследования, возраста, пола, продуктивности, физической нагрузки животного. Так, например, количество эритроцитов днем несколько меньше чем вечером, у новорожденных их содержание выше чем у взрослых, также как и у самцов по сравнению с самками. У высокопродуктивных коров показатели содержания эритроцитов выше чем у малопродуктивных. Установлено также, что у лошадей после физической нагрузки (например 10-минутная прогонка рысью — проба по Домрачеву) число эритроцитов увеличивается на 20 и более процентов.
Все эти факторы необходимо учитывать при клинической оценке результатов определения количества эритроцитов. Для подсчета эритроцитов предложено несколько методов, из которых унифицированными в медицинской практике являются два:
1. Подсчет в счетной камере с применением микроскопа;
2. Подсчет посредством электронных автоматических счетчиков. Ранее практиковались методы определения числа эритроцитов с помощью эритроседиометра (градуированной пробирки для определения СОЭ по Неводову), эритрогемометра и фотоэлектроколориметра, однако, из-за низкой их точности, в настоящее время они не используются. Погрешность же метода подсчета форменных элементов в камере составляет + 2-5%, а в автоматических анализаторах и того меньше — до + 2%. Это и предопределяет широкое применение названных методов не только в лабораторной практике, но и в научных исследованиях.
Подсчет эритроцитов в камере.
Принцип метода заключается в том, что точное количество крови равномерно смешивают с определенным количеством жидкости. Разведенную кровь помещают в камеру с известным объемом. На дно камеры нанесена сетка, благодаря которой возможен точный подсчет эритроцитов посредством микроскопии.
Предложено несколько счетных камер, из которых наибольшее распространение в странах бывшего СССР получила счетная камера с стекой Горяева. Ее нередко так и называют «камера Горяева», хотя фактически это камера Бюркера с сеткой Горяева (1910).
Счетная камера — это толстое предметное стекло с четырьмя поперечными желобками, между которыми расположены три плоскости. Средняя плоскость на 0,1 мм тоньше боковых и разделена продольным желобом на две равные половины, на каждой из которых выгравирована сетка Гряева. Если на боковые плоскости камеры наложить покровное стекло и притереть его до появления радужных колец, т.н. «колец Ньютона», то над средней плоскостью будет щелевидное пространство высотой 1/10 мм.
Сетка Горяева имеет размер 3х3 мм, т.е. ее площадь равна 9 мм2. На ней нанесено 225 больших квадратов, 25 из которых разделены на 16 маленьких, 100 квадратов не разграфлено и еще 100 разделены на прямоугольники. Площадь одного маленького квадратика составляет 1/400 мм2, а объем камеры над ним — 1/4000 мм3.
Что касается техники подсчета эритроцитов, то здесь соблюдают следующую последовательность этапов: 1) разведение крови; 2) заправка счетной камеры; 3) собственно подсчет клеток; 4) расчет абсолютного количества эритроцитов.
1 этап
. Поскольку эритроцитов в крови содержится значительное количество, например у коровы массой 400 кг — более 125 млрд. клеток, то определить их количество возможно только после разведения крови. Для разведения чаще применяют 0,85-3%-й раствор натрия хлорида или 5%-й раствор натрия цитрата. Применение растворов большей или меньшей концентрации недопустимо, поскольку приведет к разрушению эритроцитов.
Кровь разводят или в меланжере-смесителе для эритроцитов, или в пробирке (по Н.М.Николаеву, 1954). Меланжер представляет собой капиллярную трубочку длиной 10 см с шаровидным расширением. Внутри расширения находится шарик, который способствует равномерному перемешиванию крови и жидкости. Поскольку предложены меланжеры как для эритроцитов, так и для лейкоцитов, то цвет этого шарика может быть различным: красный шарик — это меланжер для эритроцитов, белый — для лейкоцитов.
Для исследования используется как стабилизированная кровь, так и нестабилизированная сразу же после взятия. Кровь набирают в меланжер до метки «0,5» или «1». Конец смесителя очищается ваткой от крови и сразу же набирается до метки «101» разбавляющая жидкость. Отверстия смесителя закрывают большим и средним пальцами и перемешивают в течение 2-3 мин., после чего удаляют на вату первые три капли, а четвертую вносят в счетную камеру. Если кровь набирали до метки «0,5», то получают разведение в 200 раз, если до «1» — в 100 раз.
При пробирочном способе разведения крови берут 4 мл раствора натрия хлорида и вносят в пробирку. Капилляром от гемометра Сали набирают 0,02 мл крови и выдувают в пробирку, затем несколько раз промывают капилляр раствором. Разведенную при этом в 200 раз кровь тщательно перемешивают.
2 этап
. Камеру располагают горизонтально и заполняют так, чтобы вся поверхность, на которую нанесена сетка, была заполнена жидкостью. При этом не должно быть образования пузырьков воздуха. После заполнения камеру оставляют строго в горизонтальном положении в течение 1 минуты для оседания эритроцитов на дно.
3 этап
. Подсчет эритроцитов проводят под микроскопом, лучше при среднем увеличении (объектив х40, окуляр х7) при несколько затемненном поле, чтобы лучше просматривались линии сетки. Учет клеток ведется в пяти больших квадратах, разделенных на 16 малых. Начинают подсчет с верхнего левого большого квадрата сетки. Затем переходят к следующему квадрату, расположенному по диагонали, затем аналогично к следующему и т.д. Есть и другой принцип подсчета — в 4-х квадратах по углам и в 1-м квадрате в центре сетки.
Подсчет клеток в большом квадрате начинают с верхнего левого малого квадратика. Затем переходят ко второму, третьему и четвертому квадратику того же ряда. Сосчитав клетки первого ряда, переходят на второй и считают в обратном порядке. Таким образом подсчитывают эритроциты во всех 16 малых квадратиках и переходят к следующему большому квадрату.
Чтобы избежать повторного учета эритроцитов в большом квадрате существует два правила их подсчета:
1) подсчитываются все эритроциты, лежащие внутри квадрата и на его левой и верхней линиях. Клетки, лежащие на правой и нижней линиях, подсчитываются с другими квадратами. В крайних правых квадратах как верхних, так и нижних, клетки, лежащие на правой и нижней линиях, подсчитываются с последними квадратами. Этот метод предусматривает подсчет только тех клеток, которые лежат внутри квадратов, на линиях и прилегают к ним с внутренней стороны. Эритроциты, лежащие вне квадрата не учитываются.
2) второй метод предусматривает подсчет в том же порядке, но отличается от первого тем, что учитываются клетки, прилегающие к линиям не только изнутри, но и снаружи. Подсчет эритроцитов при этом ведется без учета таковых, прилегающих к правым и нижним линиям. По мнению большинства исследователей первый метод является более точным.
4 этап
. Расчет абсолютного количества эритроцитов производится по формуле: Х = А.Б/В.Г, где
Х — количество эритроцитов в 1 мкл крови;
А — количество эритроцитов, подсчитанное в 5 больших квадратах;
Б — степень разведения крови (200);
В — количество маленьких квадратиков в 5 больших квадратах (80);
Г — объем счетной камеры над маленьким (1/4000 мм3).
Таким образом, формула имеет вид: Х = А.10000. Например, в 5 квадратах количество эритроцитов 590, тогда в абсолютных единицах получаем 5 900 000 клеток в 1 мкл крови. Для пересчета количества клеток в 1 л (сист. ед. СИ) необходимо результат умножить на 106, т.е. 5 900 000.106= 5,9.1012/л.
Подсчет эритроцитов посредством электронных автоматических счетчиков. Эти методы получают все большее распространение, поскольку позволяют автоматизировать исследование, повышают его точность и исключают субъективизм. Используются различные кондуктометрические счетчики, из которых наиболее известные типы это Культер (Франция), Целлоскоп (Швеция), Пикоскел (Венгрия) и др. Принцип работы таких счетчиков основан на различии электропроводности форменных элементов крови и жидкости, в которой они находятся. При этом клетки, проходя через микроотверстие капиллярной трубки, изменяют сопротивление электрической цепи, что регистрируется электромагнитным устройством. Число эритроцитов через 15-30 с высвечивается на цифровом табло.
В крови здоровых животных и птицы содержится следующее количество эритроцитов: крупный рогатый скот — 5,0-7,5; овцы — 7,0-12,0; козы — 12-18; лошади — 6,0-9,0; свиньи — 6,0-7,5; собаки — 5,2-8,4; куры — 3,0-4,0 на 1012/л.
Уменьшение числа эритроцитов (эритроцитопения, олигоцитемия) отмечается наиболее часто при анемиях различного происхождения (постгеморрагических, гемолитических, железо- и витаминодефицитных, гипо- и апластических, которые связаны с нарушением кроветворения). Эритроцитопения развивается также при инфекционной анемии лошадей, гематурии крупного рогатого скота, при многих острых и хронических интоксикациях.
Увеличенное содержание эритроцитов в крови — эритроцитоз (полицитемия) наблюдается чаще при заболеваниях, связанных с потерей организмом жидкости, в частности при диспептическом неонатальном и диарейном синдромах. Она бывает в начальную стадию инфекционных и лихорадочных заболеваний, при болевом абдоминальном синдроме, при пороках сердца в стадию декомпенсации, при отравлении фосфором, ртутью, окисью углерода, альвеолярной эмфиземе легких.
Лекция №5
Тема: ИССЛЕДОВАНИЕ СИСТЕМЫ КРОВИ
План лекции:
1. Расчет индексов красной крови и их значение в дифференциальной диагностике анемий.
2. Анемический и полицитемический клинико-лабораторные синдромы.
3. Методы и клиническое значение определения количества лейкоцитов.
4. Показания к исследованию и методы подсчета количества тромбоцитов.
1. Расчет индексов красной крови и их значение
в дифференциальной диагностике анемий
При ряде заболеваний может происходить изменение насыщенности эритроцитов гемоглобином, что устанавливают посредством расчета индексов красной крови — цветового показателя (ЦП) и содержания гемоглобина в эритроците. ЦП дает представление об отношении концентрации гемоглобина к количеству эритроцитов. Метод определения основан на сравнении полученных результатов с нормативными показателями здоровых животных.
ЦП рассчитывается по формуле: ЦП = Hb2.Е1/Hb1.Е2, где гемоглобин 1 и эритроциты 1 — это средние показатели у здорового животного данного вида и возраста; гемоглобин 2 и эритроциты 2 — это найденные показатели у исследуемого животного. Например:
У всех здоровых животных ЦП равен 1+0,15, т.е. пределы колебаний составляют от 0,85 до 1,15.
Для определения средней насышенности эритроцитов гемоглобином рассчитывают еще один индекс: СГЭ. При этом руководствуются формулой:
СГЭ = Hb (г/л):Е (1012/л).
СГЭ равно: у крупного рогатого скота — 15-20; свиней — 16-19; лошадей 17-20 пг.
Определение индексов красной крови имеет значение в дифференциальной диагностике анемий. При подострой постгеморрагической анемиии, когда одновременно уменьшается содержание гемоглобина и количество эритроцитов, ЦП приближается к 1, а СГЭ такое же как и у здоровых животных. ЦП меньше единицы и снижение СГЭ, или гипохромия, бывает при алиментарной, а также при хронической посгеморрагической анемии. Для этих нозологических форм анемии симптом гипохромии является типичным. Гиперхромия, это когда ЦП больше единицы и увеличивается СГЭ, — характерный признак гемолитической анемии, поскольку значительно уменьшается количество эритроцитов.
2. Анемический и полицитемический клинико-лабораторные синдромы
Во внутренней патологии животных выделяют следующие основные группы анемий: 1) постгеморрагические (после кровопотерь); 2) гемолитические (на почве усиленного разрушения эритроцитов); 3) гипо- и апластические (связанные с нарушением кроветворения); 4) железо- и витаминодефицитные, или алиментарные (на почве недостаточности железа, витамина В12 и фолиевой кислоты).
Анемия – клинико-гематологический синдром, характеризующийся уменьшением концентрации гемоглобина, чаще при уменьшении числа эритроцитов в единице объема крови. Характерной особенностью истинной анемии является либо функциональная недостаточность системы эритроцитов в силу пониженного содержания гемоглобина в каждой клетке, либо абсолютное уменьшение эритроцитарной массы (гиповолемия).
Анемия почти всегда вторична и является проявлением какого-то заболевания. Патогенетическим механизмом анемии может быть любое заболевание, приводящее к уменьшению количества крови в организме в результате либо острой или хронической кровопотери, либо усиленного разрушения крови (гемолиз), либо нарушения образования эритроцитов в костном мозге. При многих болезнях и патологических состояниях анемия, ее глубина и характер является ведущим синдромом и определяет прогноз заболевания.
Симптомы анемии: бледность слизистых оболочек и кожи; одышка; тахикардия со стучащим сердечным толчком; гипохромемия (олигохромемия), эритроцитопения (олигоцитемия), увеличение СОЭ. При глубокой анемии может развиться коллапс. Тяжелая гемолитическая анемия проявляется гемоглобинурией.
Анемическим синдромом у животных проявляются следующие патологические состояния и болезни: наружные и внутренние, острые и хронические кровотечения; отравления гемолитическими ядами и интоксикации; гемоспоридиозы; дефицит или нарушения усвоения железа, гиповитаминозы; нарушения эритропоэза; аутоиммунные и инфекционные заболевания с геморрагическим синдромом (см.), лучевая болезнь. Анемия развивается также при недостаточном кормлении животных.
Полицитемический синдром – патологическое состояние, характеризующееся увеличением количества форменных элементов в единице объема крови. Поскольку большая часть массы форменных элементов приходится на эритроциты, такое состояние нередко именуют эритремией, хотя этот термин правомочен лишь по отношению к системным абсолютным и первичным эритроцитозам, обусловленным патологией эритроидного ростка костномозгового кроветворения. Абсолютные эритроцитозы бывают обусловлены гипоксией, стенозом легочной артерии, метгемоглобинемией. Относительные (временные) эритроцитозы связаны с потерей организмом жидкости, стрессом, системной артериальной гипертензией, повышенной физической нагрузкой.
Симптомы полицитемического синдрома: темно-вишневая окраска слизистых оболочек, кровоизлияния; эритро- и лимфоцитоз; замедление СОЭ (у рогатого скота практически отсутствует); гепатомегалия у крупного рогатого скота, спленомегалия у лошадей.
Полицитемический синдром развивается при потере воды вследствие диареи, гипергидроза, образования транссудатов и экссудатов; при легочной недостаточности на почве бактериальных, вирусных и паразитарных пневмоний, хронической альвеолярной эмфиземы; при декомпенсированной сердечной недостаточности. Синдром может развиться при болезнях с непроходимостью желудочно-кишечного тракта (расширение желудка, метеоризм и энтералгия кишечника, илеус). Полицитемия типична для инфекционного энцефаломиелита лошадей.
3. Методы и клиническое значение определения количества лейкоцитов
Лейкоциты, или белые кровяные тельца, в организме выполняют прежде всего защитную функцию. В зависимости от форм они участвуют в фагоцитозе, выработке интерферона, лизоцима, прпердина, гистамина и других биологически активных веществ. Лимфоциты играют основную роль в специфических защитных реакциях — формировании клеточного и гуморального иммунитета.
Для подсчета лейкоцитов предложены два метода:
1. Подсчет в счетной камере (ошибка метода +7%).
2. Подсчет в автоматических счетчиках (ошибка +2%).
При подсчете лейкоцитов используют ту же камеру с сеткой Горяева, что и для эритроцитов. Разводят кровь жидкостью Тюрка в меланжере или в пробирке. Состав жидкости Тюрка: 100 мл 3%-го р-ра уксусной к-ты и 1 мл 1%-го р-ра генциан фиолетового или метиленового синего. Ее назначение состоит в том, чтобы разрушить эритроциты и окрасить лейкоциты.
При разведении в меланжере набирают кровь в смеситель для лейкоцитов до метки «0,5» или «1», а до метки «11» — жидкость Тюрка и перемешивают в течение 2-3 мин. Получают разведение соответственно в 10 или 20 раз. Для разведения пробирочным методом в пробирку отмеривают 0,4 мл жидкости Тюрка и в нее вносят 0,02 мл крови, которую набирают капилляром Сали. Содержимое пробирки тщательно перемешивают.
Заполнение счетной камеры проводят также как и при подсчете эритроцитов. Через 1-2 мин., после оседания лейкоцитов на дно камеры, проводят подсчет лейкоцитов в 100 больших неразграфленных квадратах. Расчет абсолютного количества клеток производят по формуле:
Х = А.Б/В.Г, где
Х — количество лейкоцитов в 1 мкл крови;
А — количество лейкоцитов, подсчитанное в 100 больших квадратах;
Б — степень разведения крови (20);
В — количество маленьких квадратиков в 100 больших квадратах (1600);
Г — объем счетной камеры над маленьким (1/4000 мм3).
Таким образом, формула имеет вид: Х = А*50. Например, подсчитано 180 лейкоцитов, тогда в абсолютных единицах получаем 9 000 клеток в 1 мкл крови. Для пересчета количества клеток в 1 л (сист. ед. СИ) необходимо результат умножить на 106, т.е. 9 000*106= 9*109/л.
Принцип подсчета лейкоцитов посредством автоматических счетчиков такой же как и при определении числа эритроцитов.
В крови здоровых животных и птицы содержится следующее количество лейкоцитов: крупный рогатый скот — 4,5-12,0; овцы — 6,0-14,0; козы — 8,0-17,0; лошади — 7,0-12,0; свиньи — 8,0-16,0; собаки — 8,5-10,5; куры — 20,0-40,0 на 109/л.
Увеличение количества лейкоцитов в крови — лейкоцитоз — может быть физиологическим, медикаментозным и патологическим. Физиологический лейкоцитоз бывает при беременности, после физических нагрузок, после приема корма у плотоядных, при стрессе. Медикаментозный лейкоцитоз наблюдается после парентерального введения животным белковых препаратов, вакцин, сывороток, алкалоидов и т.д.
Патологический лейкоцитоз отмечается при гнойно-воспалительных процессах, сопровождающих целый ряд внутренних болезней: бронхопневмонию, пневмонию, плеврит, перикардит, ретикулоперитонит и др. Выраженный лейкоцитоз наблюдается при многих инфекционных болезнях, лейкозах, хирургической инфекции. Возникает он и при отравлении животных ртутью, мышьяком, передозировке камфары.
Снижение числа лейкоцитов — лейкцитопения — является результатом угнетения органов кроветворения, их истощения, пониженной реактивности организма. Лейкоцитопения развивается в результате инфекционных заболеваний (классическая чума свиней, инфекционный энцефаломиелит лошадей, сальмонеллез, стахиботриотоксикоз и др.), радиационных поражений, передозировки препаратов (сульфаниламидов, левомецитина, синтомицина и др.). Выявление лейкоцитопении при заболеваниях, для которых характерен лейкоцитоз, указывает на сниженную естественную резистентность организма и тяжелое течение болезни.
Камера Горяева. Практическое применение
Лабораторная камера Горяева, названная в честь русского врача, профессора Казанского университета Горяева Н.К.
, является специальным монолитным предметным стеклом, предназначенным для подсчета количества клеток в заданном объеме жидкости. Кроме того, используя камеру Горяева можно определить увеличение микроскопа.
Камеры Горяева широко применяются в области клинических и биомедицинских исследований.
Популярные области применение камеры Горяева:
- Подсчет форменных элементов крови Подсчет эритроцитов
- Подсчет лейкоцитов
- Подсчет ретикулоцитов
- И т.п.
Камеры Горяева выпускаются в двух модификациях: двухсеточные (двухкамерные) и четырехсеточные (четырехкамерные). В определении цены камеры Горяева важную роль играет качество шлифовки стекла, метод нанесения сетки – лазерная гравировка или же вакуумное напыление.
Что собой представляет камера Горяева? Камера Горяева есть не что иное, как прозрачное монолитное предметное стекло поперечными прорезями и нанесенной специальным образом микроскопической сеткой.
В случае двухкамерной камеры Горяева мы имеем четыре прорези, образующие три поперечно расположенных площадки, при этом средняя площадка разделена продольной прорезью на две одинаковых камеры, на каждой из поверхности площадки которых нанесена сетка.
В случае же четырехкамерной камеры Горяева мы получаем предметное стекло с пятью прорезями, образующих четыре площадки, при этом две внутренние дополнительно разделены продольной прорезью для получения четырех камер с нанесенной микроскопической сеткой на поверхности площадок.
Рассмотрим более подробно особенности сетки. Специальная сетка наносится на внутренние площадки, расположенные ниже соседних боковых площадок на 0.1мм. Боковые площадки предназначены для притирания покровного стекла до появления Ньютоновских колец.
Как правило, используют специальное покровное стекло для камеры Горяева с закругленными краями. После притирания покровного стекла создается камера, закрытая с двух боковых сторон, а с двух других остаются щели (так называемые, капиллярные пространства), через которые и заполняют камеру.
Что конкретно представляет собой сетка? Микроскопическая сетка камеры Горяева расчерчена на большие и маленькие квадраты, сгруппированные различными способами.
Сетка Горяева содержит 225 больших квадратов (15 рядов по 15 больших квадратов в каждом), разграфленных вертикально, горизонтально, крест-накрест и неразграфленных. При этом размеры малых делений клетки сетки составляют 0.05мм, а больших – 0.2мм. Важно, что малый квадрат со стороной 0.
05мм во всех сетках является постоянной величиной. Не трудно рассчитать, что площадь малого квадрата равна 0.0025 мм2, а большого квадрата – 0.04мм2. Тогда получаем, что объем жидкости над квадратом, образованным большими делениями сетки Горяева, составляет 0.004 микролитра.
Подсчитав количество форменных элементов (ФЭ) над большим квадратом, можно подсчитать плотность данного типа клеток в суспензии по формуле:
X=M*2.5*105
где X – количество ФЭ/мл, M- количество ФЭ над большим квадратом.
При работе с камерой Горяева важно следить, чтобы ее рабочие поверхности оставались сухими и чистыми. Кроме того, при подсчете форменных элементов нельзя допускать наличие воздушных пузырей на сетке камеры, так как они могут мешать точности подсчета.
После работы с камерами Горяева следует выполнить их дезинфекцию одним из допустимых способов:
- Погружение в 70%-ный раствор этилового спирта на 30 минут
- Погружение в 4%-ный раствор формалина на 60 минут при комнатной температуре.
Приведем примеры применения камеры Горяева и некоторые формулы.
Практическое применение камеры Горяева
Прежде чем приступить к проведению лабораторных исследований, рекомендуется тщательно протереть камеру Горяева небольшим кусочком чистого бинта, слегка смоченного в спирте. Мы не советуем использовать для этих целей вату, так как она может оставить волокна. Таким же образом следует обработать и покровное стекло для камеры Горяева.
Учтите, что при использовании низкокачественного спирта на поверхностях может образоваться осадок, тем или иным образом мешающий проведению исследований. Чтобы избежать появления связанных с этим явлением нежелательных эффектов, рекомендуется дополнительно протереть камеру и покровное стекло чистым марлевым шариком без спирта.
Притирание покровного стекла к камере должно быть выполнено очень тщательно до появления на месте контакта радужных колец (так называемых, цветных колец Ньютона) с обоих краев.
Для лучшего притирания можно воспользоваться одной хитростью и слегка выдохнуть воздух на камеру и покровное стекло, так чтобы небольшое количество влаги сконденсировалось на поверхностях стекол, что обеспечит лучший контакт.
При отсутствии специальных покровных стекол, прилагающихся к камере Горяева, можно использовать обычные стандартные покровные стекла.
Помимо целевого использования камеры Горяева для подсчета форменных элементов крови и т.п., данное стекло может расцениваться как своеобразный эталон для определения увеличения микроскопа. Для этого следует воспользоваться следующей формулой:
X=(p1-p2)/(a*N)
где X – это увеличение микроскопа; p1 – положение левой границы клетки камеры Горяева; p2 – положение правой границы клетки или группы клеток; N – количество клеток между измеряемыми границами; a – размер клетки камеры Горяева (равен 0,05 мм).
Камера Горяева также используется для подсчёта количества клеток в культуре.
Для подсчета клеточных элементов в жидкостях, содержащих их в меньших концентрациях, используются аналогичные по конструкции
камеры Фукса-Розенталя и Нажотта, имеющие большую глубину – 0.2 мм и 0.5 мм соответственно.
Эти же камеры используются в альгологии для количественного учета фитопланктона. Часто камера Фукса-Розенталя используется для подсчета форменных элементов спинномозговой жидкости.
В отличие от камеры Горяева, большие квадраты сетки Фукс-Розенталя не разграфлены и сгруппированы по 16 квадратов, причем каждая такая группа ограничена тройными линиями.
Подсчет форменных элементов крови
Наиболее часто камеры Горяева используются именно для определения форменных элементов крови при проведении лабораторных исследований. Так для подсчета эритроцитов кровь необходимо развести в 200 раз, лейкоцитов – в 20 раз. Количество форменных элементов (ФЭ) в 1мкл крови определяют по формуле:
N=m*4000*s/q,
где N – искомое количество ФЭ в 1 мкл крови; m – число ФЭ в определенном количестве малых квадратов; q – количество малых квадратов сетки камеры Горяева, в которых подсчитывались ФЭ, s – степень разведения крови.
Формула для подсчета эритроцитов
Для подсчета эритроцитов используются 5 больших или 80 малых квадратов сетки, расположенных по диагонали. Таким образом, получаем следующую формулу:
N=m*4000*200/(5*16)=m*10000
Формула для подсчета лейкоцитов
Для подсчета лейкоцитов можно использовать один из трех методов:
1. Лейкоциты считают в 64 больших (пустых) квадратах
N=m*4000*20/(64*16)=m*78,125≈m*78
2. Лейкоциты считают по всей сетке в 169 больших квадратах (рекомендуется для образцов крови с выраженной лейкопенией)
N=m*4000*20/(169*16)≈m*29,6
3. Лейкоциты считают в 100 больших квадратах (64 пустых + 36 разграфленных квадратов по периметру сетки)
N=m*4000*20/(100*16)=m*50
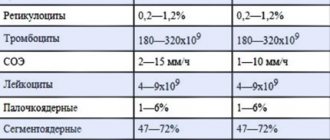
Таблица нормальных значений:
| Форменные элементы | Норма | |
| Эритроциты | Мужчины | 4 000 000 – 5 100 000 в 1 мкл |
| Женщины | 3 700 000 – 4 700 000 в 1 мкл | |
| Лейкоциты | 4 000 – 9 000 в 1 мкл |