Множественная миелома (миеломная болезнь)
Множественная миелома, миеломная болезнь, multiple myeloma.
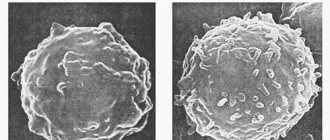
При миеломной болезни появляются клинические проявления, которые объясняются пролиферацией миеломных клеток в костном мозге и действием продуцируемых ими иммуноглобулинов и свободных легких цепей. В результате вытеснения здорового костного мозга наблюдается угнетение нормального гемопоэза, что проявляется повышенной утомляемостью, объясняемой анемией, расстройством гемостаза из-за тромбоцитопении, рецидивами инфекции в результате гипогаммаглобулинемии или лейкопении. Пролиферация миеломных клеток и активность остеокластов приводят к гиперкальциемии, появлению «штампованных» дефектов костей и патологических переломов. Отложение моноклонального иммуноглобулина или свободных легких цепей оказывает прямое повреждение почек, приводя или к тубулярному, или гломерулярному повреждению (цилиндровой нефропатии или болезни отложения легких цепей соответственно), или к инфильтрации различных органов (сердца, печени, тонкой кишки, нервов), как в случае системного AL-амилоидоза. Синдром гипервязкости крови чаще развивается при повышенном IgA или IgM моноклональном иммуноглобулине (парапротеине) и может проявляться церебро-васкулярной или дыхательной недостаточностью. Повышенная скорость оседания эритроцитов может рассматриваться как маркер моноклональной гипергаммаглобулинемии и как нередкий повод для обследования пожилых больных.
Хотя у ряда лиц симптомы миеломы впервые обнаруживаются после 50 лет, средний возраст больных во время выявления болезни равен 66 годам, и только 2% пациентов моложе 40 лет. Миеломная болезнь развивается из иммунологического состояния, определяемого как моноклональная гаммапатия неизвестного значения (MGUS-англ. или МГНЗ) . Это состояние, по американской статистике, может быть выявлено у 2-4% населения старше 50 лет. Поскольку моноклональная гаммапатия не вызывает каких-либо жалоб, то определяется лишь как случайная лабораторная находка и является предраковым состоянием. Переход от моноклональной гаммапатии неизвестного значения к миеломной болезни за год отмечается у одного из 100 лиц, пораженных МГНЗ. Такая трансформация обычно наблюдается через промежуточную стадию тлеющей миеломы (smoldering multipe myelona- SMM), при которой риск прогрессии увеличивается в 10 раз т.е. до 10% в год. На фоне тлеющей миеломы отмечается резкое увеличение содержания парапротеина в крови, достигающего уровня развернутой миеломы.
Лечение химиотерапией
Если уровень кальция опасно повышен, амилоидоз привёл к почечной недостаточности, костно-мозговое кроветворение угнетено, кости болят и имеют множественные поражения и патологические переломы, есть опасения, что на спинной мозг оказывается давление. В этом случае необходима химиотерапия. Она может осуществляться в нескольких режимах:
- В самом простом варианте назначается монохимиотерапия с чередованием курсов цитостатиков. Из препаратов применяются Мелфалан и Циклофосфамид. Первый принимается в низких дозах (0,5 мг/кг) перорально в течение 4 дней с перерывом на 4—6 недель и чередуется с регулярными внутривенными вливаниями 16—20 мг/м2 через каждые 2 недели. Циклофосфамид вводится внутримышечно по 150—200 мг в сутки.
- Для больных с худшим прогнозом проводят полихимиотерапию. Для этого используются не только Мелфалан и Циклофосфамид, но и Преднизолон, Винкристин, Доксорубицин или Дексаметазон. Однако существует мнение, что, несмотря на большую интенсивность, такая программа не увеличивает ни количество и продолжительность ремиссий, ни выживаемость.
- Во время ремиссии после химиотерапии могут применяться препараты альфа-интерферона. При их внутримышечном введении в дозе 3—6 млн единиц трижды в неделю, период улучшения продлевается. Интерферон эффективен как в сочетании с другими препаратами, так и сам по себе.
- В случаях, когда болеют люди в возрасте менее 65 лет, в основном применяется высокодозная химиотерапия Мелфаланом с последующей трансплантацией донорского или собственного костного мозга. Это позволяет с высокой степенью эффективности увеличить безрецидивную и общую выживаемость.
Потенциальное излечение может произойти только в случае успешной донорской трансплантации костного мозга. Однако этот метод ограничивается возрастом пациента и высокой вероятностью смертности (5—10%) от токсического действия самого лечения. Поэтому обычно доступным остаётся только контроль течения болезни и обеспечение продолжительной ремиссии.
Классификация множественной миеломы 2014 года
В 2014 году Международная рабочая группа по миеломной болезни обновила диагностические критерии различных форм этого заболевания. Основным изменением было добавление трех специфических биомаркеров, к существующим маркерам поражения конечных органов (гиперкальциемия, почечная недостаточность, анемия или поражение костей): количество клональных плазматических клеток в костном мозге ≥60%, соотношение свободных легких цепей в сыворотке ≥100 и более одного локального поражения на МРТ . Ранее, поражение конечных органов трактовалось как акроним CRAB — calcium, renal disease, anemia, bone lesions.
Обновленные критерии позволяют обеспечить раннюю диагностику и назначение лечения до развития поражения конечных органов. Как следует из критериев, диагноз миеломной болезни требует наличия 10% и более плазматических клеток при исследовании костного мозга или наличия плазмацитомы, доказанной биопсией, плюс одно или более нарушений, обусловленных заболеванием.
Диагностические критерии Международной рабочей группы для миеломной болезни и связанных клеточных нарушений (2014)
- Моноклональная гаммопатия неизвестного значения – МГНЗ (MGUS): моноклональный парапротеин (не-IgM) — <30 г/л, клональные плазматические клетки в костном мозге <10%, отсутствие проявлений поражения конечных органов, таких как гиперкальциемия, почечная недостаточность, анемия и поражение костей, которые могут быть связаны с пролиферацией плазматических клеток.
- Тлеющая множественная миелома (Smoldering MM): моноклональный белок в сыворотке (IgG или IgA) — ≥30 г/л, или моноклональный белок в моче ≥500 мг/24 часа и/или клональные плазматические клетки в костном мозге 10%-60%, отсутствие связанных с миеломой осложнений или амилоидоза.
- Множественная миелома: клональные плазматические клетки костного мозга — ≥10% или доказанные биопсией костные или экстрамедулярные плазмоцитомы. Для постановки диагноза необходимо выявление одного или более из следующих, связанных с миеломной болезнью, осложнений (MDE- myeloma defining event):
- Гиперкальциемия: кальций сыворотки >0.25 mmol/L или выше, чем верхний лимит нормального для соответствующей лаборатории значения или >2.75 mmol/L;
- Почечная недостаточность: клиренс креатинина <40 мл/мин или креатинин сыворотки >177 μmol/L;
- Анемия: значение гемоглобина >20 г/л ниже нижнего предела нормального в лаборатории или значение гемоглобина <100 г/л;
- Повреждение костей: одно или более остеолитических поражений при скелетной рентгенографии, компьютерной томографии или позитронно-эмиссионной томографии;
- Процент клональных плазматических клеток ≥60%: в качестве самостоятельной находки трактуется как состояние достаточное для постановки диагноза (MDE- myeloma defining event);
- Отношение вовлеченных /не вовлеченным свободным легким цепям ≥100: при условии, что концентрация вовлеченных легких цепей превышает ≥100 мг/л;
- Более одного локального поражения костей по меньшей мере 5 мм длиной при МРТ.
- Моноклональная гаммапатия неизвестного значения с парапротеином класса IgM (IgM-MGUS): все 3 критерия должны быть представлены : моноклональный IgM белок <30 г/л, лимфоплазмоцитарная инфильтрация костного мозга <10%, отсутствие признаков анемии, конституциональных симптомов, гипервязкости, лимфоаденопатии, гепатоспленомегалии, которые могут быть приписаны лимфопролиферативному расстройству (болезни Вальденстрема).
Стадии протекания болезни
- I стадия. Количество гемоглобина больше ста, уровень кальция в крови в пределах нормы, отсутствие разрушения костей. Иммуноглобулин J меньше 50 г/л, иммуноглобулин А меньше 30 г/л. Белок Бенс-Джонска в моче меньше 4 грамм в сутки.
- II стадия. Количество гемоглобина от 85 г/л до 120г/л. Умеренное разрушение костей. Иммуноглобулин J 50 – 70 г/л, иммуноглобулин А 30 – 50 г/л. Белок Бенс-Джонса 4 – 12 грамм в сутки.
- III стадия. Количество гемоглобина меньше 85 г/л. Уровень кальция в кровы превышает нормальные показатели. Заметное разрушение костей. Иммуноглобулин G выше 70 г/л, иммуноглобулин А больше 50 г/л. Белок Бенс-Джонса в моче больше 12 грамм в сутки.
По степени прогрессирования:
- тлеющая – болезнь не прогрессирует в течении многих месяцев и лет;
- медленно прогрессирующая;
- быстро прогрессирующая;
- агрессивная.
Диагностика миеломной болезни
Лабораторная диагностика и скрининг парапротеинемий основан на выявлении «парапротеина» крови. Очень чувствительным методом диагностики парапротеинемий является иммунофиксация белков сыворотки и мочи с панелью антисывороток IgG, IgM, IgA, IgE, IgD, каппа, лямбда. Диагностическая значимость обнаружения парапротеинемии значительно увеличивается при характерной клинике, указывающей на плазмаклеточное заболевание. При скрининге лиц без симптомов методом электрофореза или иммунофиксации в отсутствии клинических проявлений миеломы обнаружение парапротеина указывают на моноклональную гаммапатию невыясненного значения (МГНЗ). К клиническим показаниям для исследования парапротеина относят боли в костях, патологические переломы, полинейропатию, лихорадку, анемию. Для парапротеинемий характерны такие лабораторные находки, как увеличение скорости оседания эритроцитов, протеинурия и азотемия, гиперкальцемия, увеличение содержания общего белка сыворотки, а также отклонения от нормы в содержании основных белковых фракций. Инфекционные процессы также часто сопутствуют миеломе, поскольку синтез парапротеина подавляет синтез нормальных иммуноглобулинов, что ведет к нарушению функций иммунной системы. Иммунохимическое исследование основных иммуноглобулинов сыворотки крови IgG, IgA, IgM позволяет выявить изменение их синтеза. Однако при оценке парапротеинемий иммунохимическое определение иммуноглобулинов не рекомендовано в связи с частым феноменом «прозоны» при высоких концентрациях и неточностью измерения моноклональных молекул, поскольку особенности синтеза в миеломной клетке меняют антигенные свойства иммуноглобулинов. Во всех этих случаях методом выбора для выявления и измерения парапротеина является электрофорез с иммунофиксацией белков сыворотки и мочи. Парапротеин представлен иммуноглобулином IgG примерно у половины больных, IgA — у 20%, IgD — у 2%, IgM — у 0.5%. У 20% больных парапротеин представлен только свободными цепями иммуноглобулина. В 2-3% случаев заболевания парапротеин не определяется, что рассматривается как несекретирующая миеломная болезнь. Если быть точным, это название не соответствует действительности, поскольку при несекретирующей миеломе можно обнаружить свободные легкие цепи в сыворотке крови или моче. Диагностическая панель из сочетания электрофореза сывороточного белка, сывороточной иммунофиксации и определения свободных легких цепей в сыворотке или электрофореза с иммунофиксацией в образце 24 часовой мочи рекомендована всем лицам с подозрением на миеломную болезнь. Чувствительность обнаружения моноклональных белков равняется в среднем 82% для электрофореза белков, 93% для иммунофиксации и 97% при добавлении результатов свободных легких цепей или электрофореза белка и иммунофиксации в образце 24-часовой мочи. Отсутствие моноклонального белка примерно у 2% больных типично для несекретирующей миеломной болезни.
В подавляющем числе случаев диагностика миеломной болезни начинается после появления характерной симптоматики. Диагноз миеломной болезни после появления таких симптомов, как повышенная утомляемость и боли в спине на практике обычно запаздывает на срок свыше 3 месяцев. Хотя неизвестно, как это сказывается на исходе заболевания в целом, но частота осложнений и госпитализаций за этот период отсрочки возрастает, что негативно влияет на качество жизни больных. Многие факторы влияют на причину задержки, включая неспецифический характер жалоб и расстройств, которые нередко наблюдаются у лиц пожилого возраста и которые первоначально рассматриваются ими и их родственниками как доброкачественные. Но устойчивый характер болей в позвоночнике и повышенной утомляемости должен всегда настораживать практических врачей. Обследование по поводу мышечно-скелетных болей, анемии, тромбоцитопении, почечной недостаточности, гиперкальциемии, неврологических расстройств может привести к обнаружению моклонального белка в сыворотке или моче.
Кроме того, диагностический поиск миеломной болезни включает полный подсчет клеток крови и СОЭ, измерение уровня сывороточного кальция и креатинина, электрофорез белков сыворотки и мочи с иммунофиксацией, исследование свободных легких цепей в крови, исследование пунктата костного мозга. Дополнительно, низко-дозная КТ всего тела или ПЭТ с 18-флюородезоксиглюкозой/ КТ или ,как минимум, обзорная рентенография всего скелета требуется для выявления остеолитических поражений костей.
Поражение костей
Остеолитические разрушения костей являются центральным проявлением миеломной болезни и присутствуют у почти 80% пациентов во время установления диагноза. Генерализованное разрушение костей приводит к гиперкальциемии, ускоренному остеопорозу, формированию кифоза, клиновидным переломам позвонков. Стойкие изнурительные боли в костях являются ведущими жалобами, заставляющим больных впервые обратиться к врачу. К регулярным зонам поражения относится позвоночник и тазовые кости, что заканчивается переломами разных видов и возможной компрессией спинного мозга.
Доказано, что взаимодействие миеломных клеток с микроокружением в костном мозге приводит к выработке цитокинов, обуславливающих высокую активность остеокластов и пониженную деятельность остеобластов. Поэтому не обнаруживается признаков репарации кости в местах разрушений. Применение бифосфонатов, рентгенотерапии, балонной кифопластики и реконструктивной хирургии являются главными средствами реабилитации больных при разрушении костей. Однако костные разрушения сохраняются даже при излечении активной стадии болезни. Для выявления очагов остеолиза в костях скелета использую различные средства визуализации от рентгенографии всех костей и низкодозной комьютерной томографии до МРТ и ПЭТ всего тела. Наличие более одного фокуса лизиса в костях размером более 5 мм рассматривается как показание к назначению терапии для профилактики дальнейшего разрушения при отсутствии болевого синдрома.
Обязательной терапией деструкции и болевого синдрома при миеломной болезни в настоящее время является назначение бифосфонатов. Эти препараты были первоначально предложены для лечения остеопороза. Но они не только уменьшают боли, укрепляют кости, но также тормозят прогрессирование миеломной болезни. В связи с выделением через почки и длительной задержкой в организме бифосфонаты способны вызвать тяжелое поражение почек, простуду и гипокальциемию. Поэтому требуется мониторирования функции почек, а также электролитов (кальция и фосфора) при внутривенной терапии бифосфонатами.
Симптомы
Симптомы миелолейкоза являются:
- Боли в костях. Болят бедренные кости, позвоночник, таз, рёбра;
Боли в костях и позвоночнике
- Патологические переломы;
- Гиперкальциемия. Проявляется рвотой, тошнотой, запорами, полиурией. Могут возникнуть мозговые нарушения, человек впадает в летаргию или кому;
- Заболевания почек. Нефропатия проявляется в виде повышения содержания кальция и мочевой кислоты в крови, появления белка в моче;
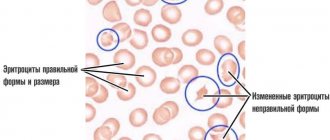
- Анемия нормохромная. Цветовой показатель крови в норме, резко вырастает СОЭ;
- Остеопороз;
- Сдавливание спинного мозга опухолями позвоночника. Проявляется в виде болей в спине, усиливающихся при кашле, чихании. Нарушается работа мочевого пузыря и кишок.;
- Беззащитность перед бактериальными инфекциями. Связана с ослаблением иммунитета;
- Геморрагии. Кровотечения из носа, матки, дёсен, подкожные кровоизлияния.
Анемия
Анемия является проявлением миеломной болезни примерно у 75% больных. Анемия обычно нормохромная и нормоцитарная, с признаками гипопролиферации (индекс ретикулоцитов <� 2,5%), с повышенным уровнем ферритина (показатель воспаления). Число гипохромных эритроцитов >5% и низкое насыщение трансферрина типичны для дефицита железа. В этих случаях уровень анемии умеренный. Но у 10% больных с Hb< 80 г/л отмечается снижение качества жизни и неблагоприятный прогноз. Анемия редко обнаруживается у лиц с начальной болезнью. Уровень гемоглобина определяет время начала лечения анемии при миеломной болезни. Несколько факторов ответственны за развитие анемии. Это инфильтрация костного мозга миеломными клетками, приводящая к уменьшению числа эритроидных клеток-предшественников, дефицит эритропоэтина у больных с почечной недостаточностью, пониженный ответ проэритробластов на эритропоэтин почек, нарушенная утилизация железа вследствие высокого уровня гепсидина при хроническом воспалении, увеличенный объем плазмы при повышенном уровне парапротеинов, побочное действие терапии. Однако главной причиной анемии при миеломной болени является вызванный миеломными клетками апоптоз эритробластов.
При стойкой симптоматичной анемии и при уровне гемоглобина менее 100 г/л следует исключить вероятность других причин анемии (Fe-дефицитной, В12-дефицитной, гемолитической, хронических инфекций и т.д.). В случае железо-дефицитной анемии, которая устанавливается по числу гипохромных эритроцитов 5% и по пониженному уровню насыщения трансферина (ОЖСС) менее 20%, используются в/в препараты железа.
Уровень гемоглобина определяет время начала лечения анемии при миеломной болезни. Одними из методов предсказание эффекта эритпропоэз-стимулирующих агентов, в частности, эритропоэтинов является определение сохранности функции костного мозга. Так как тромбомодулин, стимулирующий тромбоцитоз, синтезируется преимущественно печенью, костно-мозговой ресурс сохранен при количестве тромбоцитов в крови более 150х10^9 кл/л. Исходно пониженный уровень эритропоэтина в крови важен для предсказания положительного ответа на терапию рекомбинантным эритропоэтином, что позволяет отказаться от переливания эритроцитарной массы. Частыми побочными эффектами использования эритропоэтинов являются тромбоэмболические осложнения и артериальная гипертензия.
Другие методы
Если очаг разрастания плазматических клеток один, можно провести хирургическое лечение. Также оно, как дополнение к химиотерапии, показано при признаках сдавливания жизненно важных органов, особенно спинного мозга. Хирургическое лечение в таком случае заключается в удалении патологических образований или даже части позвоночной кости. Дополнительно назначаются глюкокортикоиды и проведение лучевой терапии.
Последняя улучшает качество жизни ослабленных больных и обычно назначается в сочетании с другими методами. Её проведение обязательно при почечной недостаточности и резистентности к химиотерапии. Как основное лечение, лучевая терапия используется при локальных костных поражениях.
Дополнительно должно осуществляться симптоматическое лечение, заключающееся во введении жидкостей и коррекции гиперкальциемии, а также приёме анальгетиков, гемостатической терапии и ортопедической помощи. В качестве препаратов, останавливающих разрушение костной ткани и предотвращающих переломы, обычно применяют Памидронат, Золедроновую кислоту или другие бисфосфонаты. В некоторых случаях анемии требуется назначение эритропоэтина и переливание эритроцитарной массы.
Поражение почек.
Существует несколько механизмов поражения почек при множественной миеломе. Легкая степень почечной недостаточности, оцениваемая как снижение СКФ ниже 60 мл/мин/1,73 м2, обнаруживается у 20% больных миеломой на этапе диагноза и примерно у половины больных в ходе миеломной болезни. Причины поражения почек комплексные и включают дегидратацию, гиперкальциемию, инфекции, воздействие нефротоксических лекарств, в частности, прием больших доз НПВС для купирования болевого синдрома.
Наиболее характерно для миеломы обнаружение тубулоинтестинального повреждения почек, известного как цилиндровая нефропатия, которая является прямым следствием повышенного содержания свободных легких цепей иммуноглобулинов в крови. Клетки канальцевого эпителия повреждаются и атрофируются из-за усиленного «переноса» свободных цепей из просвета канальцев в интерстиций. На фоне обезвоживания может развиться синдром острой почечной недостаточности, обусловленный нарушением кровотока и канальциевыми нарушениями.
Наличие легких цепей в моче при миеломной болензи может вызвать нарушение функции почек, известное как вторичный синдром Фанкони. Он обусловлен недостаточностью реабсорбционной способности проксимальных канальцев, что проявляется глюкозурией, аминоацидурией, гипофосфатемией и гипоурикемией.
В интерстиции развивается процесс воспаления с итоговым тубуло-интерстициальным фиброзом, приводящим к почечной недостаточности. Более того, невыведенные почками моноклональные легкие цепи могут откладываться в почках, сердце, печени, тонком кишечнике, нервных стволах, приводя к развитию первичного амилоидоза (AL-амилоида) или болезни отложения легких цепей (light-chain deposition disease — LCDD англ, БОЛЦ). Для диагностики почечной недостаточности требуется определение креатинина, мочевины, натрия и калия, кальция и оценка СКФ по формуле MDRD или CKD-EPI. Также рекомендуется измерение общего белка, электрофорез и иммунофиксация в образцах 24-часовой мочи. У больных с неселективной протеинурией или селективной альбуминурией требуется исключить наличие амилоидоза или MIDD , для чего показана биопсия почки или подкожного жира с окраской конго-рот. У больных с протеинурией свободных легких цепей (белка Бенс-Джонса) биопсия жира не обязательна, поскольку в этом случае диагноз миеломного повреждения почек не вызывает сомнений и требует планирования терапии основного заболевания.
Свободные легкие цепи имеют высокую чувствительность и специфичность по сравнению с электрофорезом белков в моче. Больные с почечной недостаточностью при ММ имеют повышенное каппа/лямбда отношение даже при отсутствии доказательств моноклональной гаммапатии. Причина состоит в нарушении выделения легких цепей. У здоровых людей очищение крови от легких цепей осуществляется почками. Каппа цепи являются мономерными и быстрее покидают кровь сравнительно с лямбда цепями, что доказывается каппа/лямбда отношением в среднем 0.6 у лиц без поражения почек. У больных с почечной недостаточностью основной системой очищения становится ретикуло-эндотелиальная система, полупериод жизни каппа цепей из-за этого удлиняется. Отношение каппа/лямбда оказывается при почечной недостаточности равным в среднем 1.8. Свободные легкие цепи имеют высокую чувствительность и специфичность, и больные с почечной недостаточностью имеют повышенное каппа/лямбда отношение вследствие нарушения клиренса каппа и лямбда цепей.
Инфекционные осложнения при множественной миеломе.
При миеломной болезни возрастает частота бактериальных и вирусных инфекций в 7-10 раз по сравнению с популяционным контролем. Гемофильная палочка, пневмонический стрептококк, кишечная палочка, грам-отрицательные бактерии и вирусы (грипп и герпес зостер) являются наиболее частыми виновниками инфекции у больных миеломной болезнью.
Повышенная чувствительность больных к инфекционным заболеваниям является результатом двух основных обстоятельств. Во-первых, влиянием самого заболевания, во-вторых, пожилым возрастом и побочным действием проводимой терапии. Лимфоцитопения, гипогаммаглобулинемия, нейтропения вследствие инфильтрации миеломными клетками костного мозга и под влиянием проводимой химиотерапии обуславливают повышенную чувствительность к инфекции. Связанная с болезнью недостаточность врожденного иммунитета вовлекает разные части иммунной системы и включает дисфункцию В-клеток, а также функциональные отклонения со стороны дендритных клеток, Т- клеток и натуральных киллеров (NK). Нарушения функции почек и легких, слизистой ЖКТ, мультиорганные нарушения, вызванные отложением легких цепей иммуноглобулинов, также увеличивают риск инфекционных заболеваний. Наконец, миеломная болезнь поражает преимущественно пожилых лиц с коморбидными возрастными заболеваниями и малоподвижным образом жизни, исходно предрасположенных к инфекциям.
Иммуномодуляторы и глюкокортикоиды являются частью лечения наиболее тяжелых вариантов заболевания. При имеющихся инфекционных контактах, наличии нейтропении и гипогаммаглобулинемии и подавленном клеточном иммунитете терапия иммуномодуляторами требует профилактического назначения антибиотиков.
Дополнительные исследования
Сходные миеломе признаки имеют другие злокачественные опухоли: остеомиелит и лимфоплазмоцитарная лимфома. Исключить их помогают дополнительные исследования.
Костные метастазы могут возникать при злокачественной гемангиоме, заболевании лимфоидной ткани, раке симпатической нервной системы или молочной железы. От миеломы эти заболевания отличает наличие первичного опухолевого очага, а морфологию подтверждает гистологическое исследование.
При остеомиелите поражаются трубчатые кости, а в крови протекает воспалительная реакция, поэтому при биопсии обнаруживается гной. Кроме того, это заболевание, в отличие от миеломы, более свойственно молодому возрасту.
Отличительной чертой лимфоплазмоцитарной лимфомы, вызывающей увеличение лимфатических узлов и селезёнки, поражение костного мозга и лёгких, является продуцирование моноклонального протеина и больших полипептидных субъединиц антител.
Гиперкальциемия
Симптомы гиперкальциемии неспецифичны и зависят как от абсолютных значений, так и от сроков прироста кальция. Умеренная гиперкальциемия (кальций сыворотки 3–3.5 mmol/л), которая развивалась месяцами, может переноситься незаметно с минимальными жалобами , в то время как гиперкальциемия, возникшая за недельный период, приводит к ярким симптомам. Тяжелая гиперкальциемия ( кальций более 3.5 mmol/л) почти всегда приводит к клиническим проявлениям. Больные жалуются на отсутствие аппетита и запоры. При этом общее недомогание и мышечная слабость может прогрессировать до летаргии, спутанности и комы. Кардиоваскулярные проявления включают укорочение QT интервала и аритмии. Почечная дисфункция представляется другим важным проявлением гиперкальциемии. Пациенты часто отмечают полиурию как следствие пониженной концентрационной способности почек в условиях гиперкальциемии. Появление камней в почках наблюдается только при длительной гиперкальциемии. Острая почечная недостаточность в результате прямой вазоконстрикции и натриурез-вызыванное сокращение объема крови относится к наиболее тяжелым проявлениям поражения почек при гиперкальциемии. Причиной гиперкальциемии является повышенная активность остеокластов при пониженной активности остеобластов и лизис костной ткани при миеломной болезни. Активация остеокластов, разрушающих структуру костей, вызывается цитокинами, секретируемыми миеломными клетками, в частности , интерлейкином-1. Не случайно степень гиперкальциемии зависит от общей массы накопившихся миеломных клеток, так что наиболее тяжелая гиперкальциемия обнаруживается у больных с широко распространенной болезнью.
Признаки гиперкальциемии зависят от уровня кальция и быстроты его повышения, что создает необходимость в ускоренном обследовании. Большинство причин гиперкальциемии на практике обусловлено повышенным уровнем паратгормона и его производных (гуморальная форма), а в 20 % — с инфильтрацией костного мозга клетками опухолей (инфильтративная форма). Множественная миелома с легкими цепями в крови является самой частой причиной среди заболеваний крови. Число больных с гиперкальциемий из-за наличия опухоли в 2-3 раза выше, чем из-за первичного гиперпаратиреоза.
Для миеломной болезни с гиперкальциемией характерен низкий уровень паратгормона, фосфор находится в норме. При гуморальной форме гиперкальциемии обнаруживается повышенный уровень паратгормона, низкий уровень фосфора.
Подготовка к анализу
Правила сдачи крови на общий анализ не предусматривают специфических правил подготовки. Как сдавать анализ крови на хронический миелолейкоз, известно. Кровь сдают натощак, утром, чтобы избежать «помех», искажающих результаты. В день, перед сдачей крови не рекомендуют тяжёлые физические нагрузки. Крайне нежелательно, в течение трёх суток перед процедурой, употребление жирных и жареных продуктов. Если эти условия соблюдены, то диагностический анализ крови на миелолейкоз будет чрезвычайно информативен.
Делают забор крови из вены или пальца. Венозная кровь более концентрирована, чем капиллярная, поэтому некоторые врачи требуют именно такого отбора проб на анализ.
Расшифровка результатов миелолейкоза, занимает два дня, с момента принятия результатов в обработку. Если лаборатория перегружена работой, то результат может быть получен позднее.
Современные диагностики крови предусматривают взятие образцов костного мозга на цитогенетический анализ из бедренной кости. Пробы отбирают методом биопсии или аспирации. Изучают хромосомы. Поражённые клетки содержат аномальную 22 хромосому. С целью обнаружения аномальной хромосомы используют цепную полимеразную реакцию.
Тромбофилии
Риск венозных тромбозов обусловлен целым рядом причин, а миеломная болезнь его значительно увеличивает. К факторам риска тромбозов относятся пожилой возраст,, ограничение подвижности из-за болей, частые инфекции, дегидратация, почечная недостаточность, ожирение, сахарный диабет и другие коморбидные заболевания.
Среди проявлений наиболее опасна тромбоэмболия легких, которая может оказаться фатальной.
Частота примерно тромбоэмболии при миеломе оценивается в 5-8/100 больных.
Это связано с тем, что миелома сопровождается повышенной вязкостью крови, угнетением выработки естественных антикоагулянтов и гиперкоагуляцией крови, спровоцированной инфекциями, с повышенным уровнем фактора Виллебранда, фибриногена и фактора VIII, пониженным уровнем протеина S и так далее. Проведение курса лекарственной терапии, в том числе назначение эритропоэтинов, также может сыграть роль триггера венозных тромбоэмболий. Поэтому в первые месяцы терапии рекомендуется дополнять традиционную терапию миеломы аспирином или антикоагулянтной терапией.
Скрининг предрасположенности к тромбозам и венозной тромбоэмболии при миеломной болезни, наряду со стандартным коагулогическим обследованием, должен включать исследование вязкости крови.
Причины и факторы риска
Причина, по которой происходит озлокачествление плазматических клеток, не установлена. Предположительно, имеет место генетическая предрасположенность. В качестве мутагенных факторов могут выступать вирусные инфекции, ионизирующая радиация (в том числе лучевая терапия), канцерогены, цитостатические препараты (химиотерапия), хроническая интоксикация. У 10% людей, страдающих моноклональной гаммапатией, она трансформируется в миеломную болезнь.
К предрасполагающим факторам относятся все то, что оказывает подавляющее действие на иммунную систему: ожирение, вредные привычки, нездоровый образ жизни, стрессонеустойчивость и т. д.