Вы здесь: Анализ крови —
Лимфоциты —
T-лимфоциты
- Образование и развитие
- Основные функции
- Виды
- Норма
- Причины отклонений
T-лимфоциты (t-лимфоциты) — клетки, предшественники агранулоцитов, образуются в костном мозге. Принимают активное участие в работе иммунной системы, защищают организм от патогенного воздействия. Понижение или повышение количества Т-клеток в крови может свидетельствовать о развитии определенного патологического процесса.
Специфической симптоматики нарушения нет: определить отклонение содержания Т-клеток в крови от нормы можно только диагностическим путем. Общий маркер Т-лимфоцитов — CD3. Основные субпопуляции представлены пятью видами.
Образование и развитие
Субпопуляции Т-лимфоцитов находятся в костном мозге, образуются организмы из стволовых клеток. Созревание Т-лимфоцитов происходит в вилочковой железе (тимусе), после чего клетки поступают в селезенку, лимфатические узлы и начинают циркулировать по крови. На данном этапе начинается их полноценное функционирование — обеспечение защитных функций организма.
В процессе дифференциации клеток выделяют два основных этапа:
- антигензависимая дифференцировка Т-лимфоцитов — осуществляется в периферических органах иммунной системы;
- антигеннезависимая дифференцировка Т-лимфоцитов — осуществляется только в тимусе (вилочковая железа).
Жизненный цикл T-лимфоцитов разный: одни клетки могут жить несколько месяцев, другие — несколько лет и даже десятилетий. Не исключается, что Т-лимфоцит может проциркулировать в крови всю жизнь человека, если будет клеткой памяти. Такие клетки находятся в разных местах организма и обеспечивают пожизненный или очень длительный иммунитет человека. Подобные функции клетка получает после встречи с чужеродным организмом.
Что такое лимфоциты в анализе крови?
Лимфоциты lymph – это белые кровяные клетки (разновидность лейкоцитов), посредствам которых реализуется защитная функция организма человека от чужеродных инфекционных агентов и собственных мутантных клеток.
Лимфоциты абс – это абсолютное число данного вида клеток, определяемое по формуле:
Общее количество лейкоцитов * Содержание лимфоцитов (%)/100
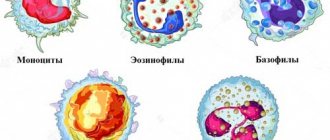
Активированные лимфоциты подразделяются на 3 субпопуляции:
- Т-лимфоциты – созревают в тимусе, ответственны за реализацию клеточного типа иммунного ответа (непосредственное взаимодействие иммунных клеток с патогенами). Они подразделяются на Т-хелперы (принимают участие в антигенпрезентации клеток, степени выраженности иммунной реакции и в синтезе цитокинов) и цитотоксические Т-лимфоциты (распознают чужеродные антигены и уничтожают их за счёт выброса токсинов или внедрения перфоринов, которые повреждают целостность цитоплазматической мембраны);
- В-лимфоциты — обеспечивают гуморальный иммунитет посредством выработки специфических белковых молекул – антител;
- NK-лимфоциты (натуральные киллеры) – растворяют клетки, зараженные вирусами или подвергшиеся злокачественному перерождению.
Известно, что лимфоциты в крови способны синтезировать на своей поверхности ряд антигенов, при этом, каждый из них уникален для своей субпопуляции и этапа формирования клетки. Функциональная активность подобных клеток различна. В большинстве случаев они являются мишенью для других лейкоцитов на этапе иммунофенотипирования.
Кластер дифференциации и его типы
Кластер дифференциации (cluster designation) – искусственно созданная номенклатура с присвоением номера различных антигенов, которые вырабатываются на поверхности лимфоцитов в крови. Синонимы термина: CD, CD-антиген или CD-маркер.
Во время лабораторной диагностики наличие меченых клеток в общей субпопуляции белых кровяных телец определяется при помощи моноклональных (одинаковых) антител с метками (на основе флюорохрома). При взаимодействии антител со строго специфичными CD-антигенами образуется устойчивый комплекс «антиген-антитело», при этом можно произвести подсчёт оставшихся свободными антител с меткой и определить количество лимфоцитов в крови.
Выделяют 6 типов кластеров CD-антигенов:
- 3 – характерен для Т-лимфоцитов, принимает участие в образовании комплекса передачи сигнала по мембране;
- 4 – идентифицируется на нескольких типах лейкоцитов, способствует облегчению процесса распознавания чужеродных антигенов при взаимодействии с MHC (главный комплекс гистосовестимости) 2 класса;
- 8 – представлен на поверхности цитотоксичных Т-, NK-клеток, функционал аналогичен предыдущему типу кластеров, только распознаются антигены связанные с MHC 1 класса;
- 16 – присутствует на различных видах белых кровяных телец, входит в состав рецепторов, отвечающих за активацию фагоцитоза и цитотоксичного ответа;
- 19 – компонент В-лимфоцитов, необходим для их правильной дифференциации и активации;
- 56 – вырабатывается на поверхности NK- и некоторых Т-клеток, необходим для обеспечения их прикрепления к тканям, поражённых злокачественными опухолями.
Основные функции
T-лимфоциты совместно с другими клетками крови обеспечивают эффективную работу иммунной системы. В человеческом организме Т-клетки решают массу крайне важных задач:
- синтезируют антитела;
- уничтожают чужеродные клетки;
- отвечают за иммунную память;
- уничтожают собственные клетки-мутанты;
- обеспечивают повышенную сенсибилизацию организма.
Все клетки этого типа внутри морфологически одинаковы, но свойствами поверхностных рецепторов будут отличаться.
Виды
Т-лимфоциты представлены в пяти видах, каждый из которых выполняет важные функции для организма. Различают следующие виды Т-лимфоцитов:
- Т-лимфоциты хелперы или «помощники» — присутствуют практически везде, «командуют» другими клетками, которые ускоряют или подавляют иммунный ответ;
- цитотоксические Т-лимфоциты или «киллеры» — убивают чужеродный организм за счет воздействия специального вещества (лимфокина), одна клетка может убить один патогенный организм;
- регуляторные Т-лимфоциты или супрессоры — подавляют реакцию;
- клетки иммунологической памяти — «запоминают» чужеродный организм и при попадании последнего в организм снова патоген будет мгновенно идентифицирован, что ускорит запуск процессов его уничтожения.
Кроме того, к В и к Т-лимфоцитам относятся нулевые клетки, которые не имеют точной морфологической структуры и функций при зарождении, но могут трансформироваться (в зависимости от обстоятельств) в В или Т-клетки. Функции будут выполнять такие же, как «киллеры», но рецепторы у них несколько другие, так как уничтожение чужеродного организма происходит без развития иммунной реакции. Такие типы Т-лимфоцитов не имеет определенной нормы в крови ребенка или взрослого человека.
Определить, какие именно Т-лимфоциты в крови в норме, а каких не хватает, можно путем проведения лабораторного развернутого биохимического анализа крови.
Работа резидентных Т-клеток: не стоит путать туризм с эмиграцией
Мышиные резидентные клетки тканей в нормальной ситуации почти не перемещаются внутри нелимфоидной ткани и достаточно прочно прикреплены молекулами адгезии к строме органа. Когда резидентные макрофаги той же ткани секрецией цитокинов инициируют реакцию воспаления, ТRM приобретают большую подвижность и патрулируют близлежащий эпителий в поисках зараженных клеток.
Если воспалительная реакция усиливается, то клетки понимают это как сигнал о подкреплении: к работе патрульных TRM подключаются вновь прибывающие из крови TCM- и TEM-клетки. Эти клетки крови куда более подвижны и лучше перемещаются в эпителии. Значит ли это, что именно в крови находятся готовые действовать Т-киллеры среди TEM, а CD8+ TRM выполняют в ткани хелперные и регуляторные функции?
С одной стороны, Т-хелперы по спектру Т-клеточных рецепторов более тканеспецифичны, т.е. пересечений между репертуарами TCR клеток, взятых из разных тканей, совсем мало, тогда как клетки одного клона Т-киллера встречаются в разных тканях среди TEM [6]. Спектр функций и репертуар антигенной специфичности TRM еще предстоит исследовать, но способности к уничтожению зараженных клеток тканей у TRM-киллеров точно есть. Более того, в модели мышиной инфекции полиомавирусом, протекающей в ткани головного мозга, аффинность вирусоспецифичных Т-клеточных рецепторов резидентных киллерных клеток выше, чем у вирусоспецифичных клеток центральной памяти [10].
Однако размер популяции Т-клеток зависит не только от специфичности TCR к инфекциям, которые раньше протекали в данном органе, но и от гомеостатической пролиферации Т-клеток — размножения более удачливых клеток для заполнения емкости органа по числу Т-лимфоцитов. По маркерам CD28 и CD127 на поверхности клеток можно отличить недавно и давно активированные через TCR клетки от тех, которые получили только гомеостатический сигнал к пролиферации от фактора роста IL-7. При старении ткани гомеостатическое размножение клеток начинает преобладать над пролиферацией активированных через TCR клеток.
Независимо от Т-клеточных рецепторов часто функционируют NKT-клетки, тип резидентных клеток печени, встречающихся и в других тканях. Они могут быть активированы NK-клеточными рецепторами через распознавание не индивидуальных антигенов, а общих молекулярных паттернов опасности и тканевого стресса. При активации CD8+ NKT-клетки выделяют цитотоксические гранулы и лизируют подозрительные клетки ткани, к примеру единичные опухолевые клетки и зараженные вирусами клетки, экспрессирующие и выставляющие на внешней мембране стрессорные молекулы. При старении тенденция TRM к активации без Т-клеточного рецептора, через NK-клеточные рецепторы или цитокиновые сигналы, может приводить к ошибочному лизису клеток ткани, недостаточному контролю над хронически зараженными или перерождающимися участками эпителия.
Патологические проявления, связанные с работой резидентных Т-клеток, включают органоспецифичные аутоиммунные синдромы и синдромы хронического воспаления в ткани. Примеры хронического воспаления, поддерживаемого резидентными Т-лимфоцитами, — контактный дерматит и псориаз, а механизмом служит выделение воспалительных факторов IL-17 резидентными Т-киллерами и IL-22 резидентными Т-хелперами дермы. CD8+ эффекторные Т-киллеры, находящиеся в головном мозге, похожи по совокупности мембранных молекул-маркеров на TRMкожи, кишечника и легких и способны подталкивать развитие перемежающегося рассеянного склероза при периодических выбросах воспалительных цитокинов. Неясно, однако, есть ли в норме в головном мозге популяция TRM или же это Т-лимфоциты, оставшиеся в ткани после нейротропной вирусной инфекции [8].
Функции резидентных клеток памяти в норме — при отсутствии инфекции или хронического воспаления — могут включать cross-talk
(взаимную регуляцию преимущественно через секрецию цитокинов и костимуляторные молекулы) с неклассическими малоизученными лимфоидными клетками. Ими могут быть ассоциированные со слизистыми γ/δ Т-клетки, несущие альтернативный вариант сборки Т-клеточного рецептора, или лимфоидные клетки врожденного иммунитета (
Innate Lymphoid Cells
, ILC), которые делят с Т- и В-лимфоцитами общие черты эпигенетического ландшафта, но не имеют Т-/В- или NK-клеточных рецепторов [11, 12].
Рисунок. 5. Предполагаемые функции резидентных Т-лимфоцитов тканей.
Часть функций может выполняться во взаимодействии с резидентными макрофагами
Прим. ред.: γ/δТ-клетки, составляющие около 5% от всех Т-клеток, являются либо CD8-позитивными, либо СD4-, CD5- и CD8-негативными. Подобно естественным киллерам они являются «врожденными» цитотоксическими эффекторными клетками и не требуют сенсибилизации антигеном для активирования. γ/δТ-клетки имеют тропность распределения и находятся главным образом в красной пульпе селезенки, эпителии тонкой кишки, коже. Распределение этих клеток в условиях нормы коррелирует с лока-лизацией γ/δТ-клеточных лимфом. γ/δТ-клетки не рестриктированы по главному комплексу гистосовместимости (MHC – major histocompatibility complex), т.е. для распознавания антигена Т-клеточным рецептором не требуется контакта на поверхности клетки с молекулами MHC. Они являются первой линией защиты при бактериальных инфекциях, в частности микобактериальных, и играют важную роль в иммунной защите слизистых оболочек.
TRM клетки контактируют с антигенпрезентирующими клетками тканей — дендритными клетками кожи и резидентными макрофагами тканей. Резидентные миелоидные клетки в разных тканях дифференцированы и слабо похожи друг на друга. К примеру, макрофаги маргинальной зоны селезенки, макрофаги печени и микроглия (макрофаги мозга) будут сильно отличаться и по морфологии, и по спектру функций. Кроме обнаружения антигенов в ткани, резидентные макрофаги заняты регуляцией процессов старения и самообновления тканей, в частности, выделяют факторы роста и цитокины, стимулирующие деление стволовых клеток тканей. В жировой ткани, к примеру, макрофаги стимулируют дифференцировку новых жировых клеток, но при переходе в активированное M1-состояние запускают воспаление и вместо дифференцировки заставляют увеличиваться и набухать имеющиеся жировые клетки. Сопутствующие изменения метаболизма жировой ткани приводят к накоплению жировой массы и в последние годы связываются с механизмами развития ожирения и диабета II типа. В коже цитокины, выделяемые макрофагами и резидентными γ/δ Т-клетками, стимулируют деление стволовых клеток при регенерации эпидермиса и стволовых клеток волосяных фолликулов [13, 14]. Можно предположить, что хелперные TRM-клетки при патрулировании эпителия и образовании контактов с тканевыми макрофагами могут модулировать спектр и объем выделяемых последними факторов роста для стволовых клеток, воспалительных цитокинов и факторов ремоделирования эпителия — и тем самым участвовать в обновлении тканей.
Норма
Нормальные значения количества данных клеток в крови будут меняться с возрастом — это нормально и патологией не считается. До шестилетнего возраста в крови будут преобладать лимфоциты, а далее функцию этих клеток по большей части будут выполнять нейтрофилы. Уменьшение количества клеток с возрастом обусловлено уменьшением в размерах вилочковой железы, где происходит развитие Т-лимфоцитов и их дифференциация.
Нормой будут следующие показатели Т-клеток от общего количества лимфоцитов по возрастным группам:
- новорожденные — 12–36 %;
- первый месяц — 40–76 %;
- до шести месяцев — 42–74 %;
- до года — 38–72 %;
- до 12 лет — 24–54 %;
- 13-15 лет — 22–50 %;
- после 16 лет и в течение жизни — 19-–37 %.
Незначительно отклонение в показателях не считается патологией. Большие расхождения с параметром нормы однозначно будут свидетельствовать о развитии патологического процесса в организме. В таком случае назначают повторный анализ (для исключения вероятности ошибки) и комплексное обследование (для определения причины развития аномалии и назначения корректного лечения).
Как отличить резидентные клетки тканей от примесей клеток крови?
Резидентные Т-клетки корректно, но неудобно каждый раз определять по способности индивидуальной клетки мигрировать в лимфоузлы, поэтому необходимо составить список характерных признаков, по которым можно выявить принадлежность к этой субпопуляции. Резидентные Т-лимфоциты в тканях — естественных барьерах организма (например в легких и слизистой тонкого кишечника) немного похожи на классические эффекторные клетки крови: экспрессируют маркер активированных клеток CD69, причем экспрессия стабильна в течение жизни при взрослении и старении и характерна для всех нелимфоидных тканей. Но вдобавок CD69 колокализуется с маркером CD103, который обозначает группу молекул адгезии — интегринов, способствующих прикреплению резидентной Т-клетки к эпителию и к фибробластам в подслизистой выбранного органа. Для эффекторных Т-клеток во вторичных лимфоидных органах экспрессия интегринов CD103 совершенно нехарактерна: TEM-клетки постоянно сохраняют подвижный фенотип.
У карты, составленной коллективом Донны Фарбер, есть крупный недочет: неясно, насколько чисто удается выделить Т-лимфоциты из органа, какую долю анализируемых клеток на самом деле составляют Т-лимфоциты крови из капилляров внутри органа.
Особенно остро вопрос загрязнения клетками крови стоит для легких — неслучайно субпопуляционный состав Т-клеток легких неожиданно похож на Т-клетки крови и лимфоузлов. Вопрос загрязнения клетками крови был изящно решен для Т-лимфоцитов мыши: подопытных животных заражали вирусом лимфоцитарного хориоменингита после пересадки трансгенного клона Т-клеток P14, специфичного к данному вирусу. В результате при инфекции большая часть циркулирующих клеток была представлена вирусоспецифичным клоном P14, а его присутствие в тканях можно было выявить с помощью флуоресцирующих антител к TCR P14. Мышам в кровь вводили антитело анти-CD8 к маркеру Т-киллерных клеток, оно быстро распространялось по кровотоку и связывалось со всеми Т-киллерами в крови (но не в тканях). При микроскопии срезов органов легко было отличить резидентные киллерные TRM от только недавно вышедших из крови в орган клеток, помеченных анти-CD8 антителом []. Численность резидентных клеток, подсчитанная этим методом, в 70 раз превышала количество, определенное методом проточной цитометрии; разница меньше чем в два раза наблюдалась только для резидентных клеток лимфоузлов и селезенки. Получается, стандартные методики выделения лимфоцитов из органов плохо подходят для анализа киллерных резидентных клеток и существенно занижают размеры популяции.
Возможные причины отклонения от нормы
Непатологические причины повышения количества Т-клеток в крови:
- чрезмерные физические нагрузки;
- стресс, эмоциональное возбуждение;
- употребление спиртных напитков;
- временной отрезок до месячных и после менструации (у женщин)
- беременность.
Что касается патологических факторов, которые могут стать причиной отклонения от нормы, следует выделить такие:
- заболевания центральной нервной системы;
- аутоиммунные и системные заболевания;
- хронические патологические процессы;
- нарушения эндокринного характера;
- некоторые вирусные заболевания;
- период выздоровления;
- инфекционные заболевания;
- побочные действия некоторых медикаментозных препаратов;
- онкологические процессы;
- вторичный иммунодефицит;
- последствия лучевой и/или химиотерапии;
- острая или хроническая недостаточность кровообращения;
- аллергическая реакция.
В таких случаях присутствует отклонение от нормы не только Т-клеток, но и других компонентов крови. Определить причину нарушения только по одному биохимическому анализу невозможно — требуется проведение комплексного обследования.
Специфических препаратов, которые бы воздействовали на численность именно Т-клеток крови, не существует. Периодически нужно проходить медицинское обследование или хотя бы сдавать анализ крови. Такие простые профилактические мероприятия позволят своевременно диагностировать проблему и начать лечение.
Резидентные Т-клетки в старении тканей человека
Карта соотношений присутствия отдельных субпопуляций Т-клеток в разных органах человека, как ни странно, была составлена только в 2014 г. Команда Донны Фарбер из медицинского центра Колумбийского университета Нью-Йорка провела сравнение фенотипов Т-клеток, выделенных из крови и тканей доноров органов всех возрастных групп от 3 до 73 лет (всего 56 доноров) [6]. Анализ субпопуляций Т-клеток при помощи проточной цитофлуориметрии подтвердил многие данные, полученные методами с меньшим разрешением и меньшей статистикой, и некоторые черты описания иммунной системы, перенесенные с иммунологии мыши на человека, к примеру снижение содержания наивных Т-лимфоцитов во всех органах при старении организма.
Уменьшение числа наивных Т-клеток с возрастом связано с быстрым старением вилочковой железы, в которой будущие Т-клетки проходят этапы сборки TCR, проверку его работоспособности и селекцию на отсутствие аутоиммунного потенциала. Важно не только снижение абсолютной численности наивных Т-клеток, но и уменьшение разнообразия репертуара Т-клеточных рецепторов, а значит, и возможности сформировать адаптивный иммунный ответ на ранее незнакомую инфекцию [7]. Для наивных Т-киллеров подтвердилось прогрессирующее падение численности в крови и лимфоузлах, хотя для наивных Т-хелперов отрицательная корреляция численности с возрастом в данном исследовании оказалась значительной только для вторичных лимфоидных органов, но не для крови.
Рисунок. 4. Пути циркуляции Т-лимфоцитов различных субпопуляций [8].
Наивные Т-клетки вместе с субпопуляцией TCM путешествуют по кровеносным сосудам заходят и в Т-клеточную зону различных лимфоузлов, в ткани не выходят, хотя в их капиллярах встречаются (красная траектория
). Эффекторные ТEM-клетки перемещаются по лимфо- и кровотоку, могут попасть в лимфоузел, но в Т-клеточную зону не заходят (
траектория лилового цвета
). Резидентные ТRM-клетки (показаны
зеленым
в коже и
различными цветами
в слизистых) перемещаются только внутри ткани (
траектория зеленого цвета
)
Выделение Т-лимфоцитов памяти, эффекторных клеток памяти и короткоживущих эффекторных клеток из слизистых легких, тонкого и толстого кишечника, паховых и мезентериальных лимфоузлов доноров органов позволило впервые оценить динамику данных популяций в тканях человека при старении. Доля центральных клеток памяти ожидаемо растет с течением жизни, в соответствии с ростом числа инфекций, которые успели встретиться организму и попасть в библиотеку памяти иммунной системы. Эффекторные клетки памяти TEM стремительно заполняют нишу для Т-клеток в тканях ребенка, быстро, примерно к 12 годам, вытесняя наивные Т-клетки. Растет и количество терминально дифференцированных эффекторных Т-киллеров (TEMRA), но только в лимфоузлах и в селезенке; в нелимфоидных тканях численность TEMRA падает. Короткоживущие терминально дифференцированные Т-киллеры чаще всего встречаются в крови, селезенке и слизистых легких в любом возрасте, а вот среди Т-хелперов эта субпопуляция представлена исчезающе малым числом клеток. Аналогично мало центральных клеток памяти среди Т-киллеров, преимущественно они находятся в слизистых двух барьерных тканей: легких и кишечника.
Широкими мазками карту распределения Т-лимфоцитов человека можно обрисовать так: наивные Т-клетки путешествуют по крови и периодически заходят во вторичные лимфоидные органы, киллеры TEMRA находятся в крови, селезенке и легких. Для центральных клеток памяти, судя по всему, характерно более индивидуальное распределение по тканям, чем для других субпопуляций: во всяком случае, закономерностей динамики при старении разных тканей выявить не удалось. Эффекторные клетки памяти, включающие и TRM-субпопуляцию, доминируют среди Т-клеток слизистых барьерных тканей. В целом, при старении Т-клеточного иммунитета нелимфоидные ткани проявляют большую стабильность субпопуляций, лимфоидные ткани — большую возрастную динамику типов Т-клеток [6]. Стабильность тканевых клеток проще объяснить, если разобраться, какие из эффекторных клеток TEM остаются в ткани, становятся резидентными TRMи из каких событий состоит их жизнь после отказа от путешествий по организму.