Апластическая анемия — это частный случай нарушения синтеза эритроцитов, сопровождается падением концентрации гемоглобина в результате отклонения в работе костного мозга.
В отличие от прочих форм нарушения, например железодефицитной, мегалобластной, патология куда сложнее излечивается, имеет худшие прогнозы.
Клиническая картина сама крайне опасна, несет большую угрозу для существования организма. Процесс дает кровотечения различной локализации, которые трудно остановить.
Диагностика представляет определенные сложности по причине отсутствия специфических клинических признаков, если проводить исследование рутинными способами.
Лечение строго стационарное. Длительность его неопределенно высокая, зависит от тяжести патологического процесса, характера его течения, агрессивности, стадии, также индивидуальных особенностей организма человека, первичной причины становления нарушения.
Классификация
Различают врожденные (конституциональные) и приобретенные формы Гипопластической анемии. Врожденные Гипопластические анемии встречаются сравнительно редко. В зависимости от характера угнетения кроветворения выделяют формы с поражением всех трех ростков (истинная Г. а.) или только эритропоэза (парциальная Г. а.). Иногда выделяют Г. а. с гемолитическим компонентом, но некоторые авторы считают, что она представляет собой гипопластическую стадию пароксизмальной ночной гемоглобинурии (см. Гемолитическая анемия).
Симптоматика
Почти каждое малокровие, как и гипопластическая анемия, имеет две основные проблемы:
- Признаки заболевания. Симптомы проявляются постепенно, на первых этапах развития патологии остаются незамеченными. Затем появляются первичные признаки, на которые только малая доля пациентов обращает внимание.
- Люди. Вторая проблема в самих людях. Большинство из них игнорирует незначительное изменение своего состояния, не обращают внимания на ухудшение своего самочувствия. Но если некоторые делают это только на раннем этапе развития анемии, то есть и такие, кто терпит дискомфорт и боль до последнего, пытается заниматься самолечением и обращается за помощью уже на самых последних этапах.
В этом главная загвоздка. Чем раньше диагностируется анемия (малокровие), тем больше шансов на полноценное выздоровление и восстановление организма. Позднее обращение приводит к тяжёлым последствиям, а иногда и к фатальным исходам.
Потому вам стоит знать, с чего начинает проявляться гипопластическая анемия, и на что важно своевременно реагировать.
При начальных этапах развития заболевания кроветворения человек ощущает:
- общую слабость в организме;
- заметную потерю аппетита;
- приступы головокружения без объективных причин;
- озноб.
Согласны, что подобная симптоматика часто остаётся без внимания, поскольку люди списывают всё на физическую или психоэмоциональную усталость. В редких случаях человек обращается за помощью. Ему проще немного отдохнуть, выпить какую-то таблеточку и ждать, пока всё само пройдёт.
Длительное развитие болезни и её переход в более тяжёлое состояние затрудняют диагностику. Но есть случаи, когда гипопластическая анемия развивалась стремительно и проявлялась в виде:
- болевых ощущений в костях;
- частичной или полной утраты подвижности конечностей;
- геморрагических симптомов;
- побледневших кожных покровов и пр.
Пациенты с таким диагнозом отмечают изменения в работе сердечно-сосудистой системы. Симптомы следующие:
- снижается показатель артериального давления;
- сердечный тон становится глухим;
- наблюдаются систолические шумы;
- проявляются признаки тахикардии.
Ещё одна проблема состоит в том, что кроветворная система существенно угнетается, нарушаются её функции, истощается костный мозг. На фоне таких изменений способны формироваться сопутствующие патологии. И здесь палка о двух концах, поскольку для их лечения требуется нормальное состояние кроветворной системы.
Последствиями такого состояния человека при гипопластической анемии могут стать:
- развивающиеся в организме пациента инфекционные патологии, сопровождающиеся значительным повышением температуры тела;
- возникновение разных видов кровотечений (у мужчин чаще течёт кровь из носа, а у женщин проявляются маточные кровотечения);
- происходящие в серозные или слизистые оболочки излияния крови, что обусловлено дефицитом тромбоцитов.
Заметив даже самые слабые симптомы и изменения своего привычного самочувствия без объективных причин, лучше для профилактики обратитесь к врачу и пройдите обследование. Даже раз в год сдавая простейшие анализы, вы убережёте себя от целого ряда болезней, сможете остановить их развитие на раннем этапе. Это куда проще и правильнее, чем лечить уже устоявшуюся патологию.
История
В 1888 г. П. Эрлих описал заболевание у молодой женщины, при к-ром остро развилась кровоточивость, лихорадка, глубокая анемия и лейкопения (тромбоциты в то время не подсчитывали); на вскрытии отсутствовали признаки кроветворения в костном мозге, что П. Эрлих объяснял первичным угнетением его функции. Термин «апластическая анемия» впервые предложил Шоффар (А. М. Chauffard, 1904). В дальнейшем была выделена апластическая анемия типа Эрлиха, при к-рой наряду с неуклонно прогрессирующей панцитопенией, нередко осложненной сепсисом, резко выраженными геморрагиями и некротическими явлениями, гистологически в костном мозге не выявлялись признаки кроветворения; болезнь наблюдалась у лиц в возрасте от 18 до 20 лет. Сходное заболевание под названием «геморрагическая алейкия» описал Франк (Е. Frank, 1915). С введением в практику в 1927 г. М. И. Аринкиным пункционного исследования костного мозга появилась возможность отличать истинные Гипопластические анемии от панцитопений, обусловленных лейкозным или метастатическим поражением костного мозга. В отечественной литературе первые описания Г. а. под названием «клинико-гематологический синдром» принадлежат Г. П. Хосроеву (1913). Г. а. как отдельной нозологической форме посвящены работы X. X. Владоса (1937), Е. А. Кост (1952), И. А. Кассирского и Г. А. Алексеева (1962), Ф. Э. Файнштейна (1965), Г. С. Мухамедзяновой (1970) и др.
Статистика детально не изучена. По статистическим данным московских прозектур, частота Г. а. составляла в 1928—1932 гг. 0,009%, в 1945—1950 гг. 0,13%, в 1951 — 1956 гг. 0,25%. В США (по данным штата Калифорния, 1967) заболеваемость Г. а. составляла 2 случая на 1 млн. чел., или 1:400000 — 1 : 700 000. Выраженной зависимости заболеваемости от пола, возраста и этнической принадлежности не установлено.
Причины развития
Гипопластическая анемия может быть обусловлена негативным действием различных факторов, их совокупность способствует не только развитию болезни, но и приводит к усугублению течения патологического процесса.
Очень часто данный вид анемии возникает вследствие токсического действия некоторых медикаментов, способных спровоцировать нарушения в костном мозге с дальнейшей дисфункцией ростков кроветворения. Ее формирование не зависит от дозировки медикаментов и от длительности терапевтического курса.
К препаратам, способным вызвать нарушения в системе кроветворения, относят:
- сульфаниламиды,
- антибиотики,
- антигистаминные,
- тетрациклины.
Очень часто недуг определяют у лиц, длительно принимающих Левомицетин
Нарушение гемопоэза наблюдается после курса химиотерапии, так как токсическое действие препаратов разрушает не только патологические образования, но и здоровые клетки и ткани.
Причинами расстройства кроветворной функции также являются аутоиммунные болезни, при которых иммунный механизм направлен на угнетение не только патогенных микроорганизмов, но и на собственное повреждение элементов костного мозга.
Таким образом, различают три группы основных причин, вызывающих нарушение кроветворной функции костного мозга:
- Наследственная. Передача генетически модифицированных генов, проявляющаяся хромосомными аномалиями.
- Основная. Токсическое воздействие химиопрепаратов, радиационное излучение, отравление мышьяком и бензолом.
- Редкая. Формируется на фоне приема некоторых медикаментов, при инфицировании грибком.
Факторы, провоцирующие развитие заболевания:
- гепатит вирусного происхождения;
- вирус герпеса;
- цитомегаловирусная инфекция;
- ВИЧ-инфекция.
Ионизирующее излучение, применяющееся в ходе рентгенологического исследования, играет важную роль в механизме формирования анемии. Чаще всего данная патология встречается у работников рентгенологических кабинетов, а также у пациентов, прошедших курс радиоволновой терапии.
Этиология
Гипоплазия кроветворения может быть обусловлена воздействием разнообразных внешних факторов, которые принято делить на две группы: 1) факторы с облигатным миелотоксическим эффектом, пропорциональным величине дозы,— ионизирующая радиация, бензол и его производные (развивается бензольная анемия), противоопухолевые препараты (хлорэтиламины; фосфорамиды; антиметаболиты — антагонисты фолиевой к-ты, аналоги пуринов, пиримидинов и др.; антимитотические средства — колхицин, алкалоиды барвинка; антибиотики — брунеомицин, рубомицин, адриамицин, карминомицин), неорганические соединения мышьяка, эстрогены и др.; 2) факторы с факультативным миелотоксическим эффектом, обнаруживаемым лишь в единичных случаях — антибактериальные, противосудорожные, антитиреоидные, антигистаминные препараты, транквилизаторы (развивается апластическая постмедикаментозная анемия), инсектициды и др.; прямой связи развития Г. а. с дозой и длительностью применения препарата в этих случаях не отмечается. Ко второй группе должны быть отнесены сравнительно редкие случаи развития Г. а. при туберкулезе, беременности. Г. а., связанная с приемом в пищу перезимовавшего зерна (см. Алейкия алиментарно-токсическая), практически не встречается.
Из факторов с факультативным миелотоксическим эффектом наиболее опасен антибиотик левомицетин (хлорамфеникол). По данным Валлерштейна с сотр. (R. О. Wallerstein, 1969), у лиц, принимающих левомицетин (см.), возможность заболеть Г. а. в 13 раз выше, чем у населения в целом. Реже описывают Г. а. в связи с приемом органических соединений мышьяка (мафарсен и др.), противомалярийных препаратов, производных гидантоина, фенилбутазона, солей золота.
Гипопластическую анемию, вызванную воздействием различных внешних факторов, называют миелотоксической анемией. Примерно в 50% случаев Г. а. выявить причину заболевания не удается — так наз. идиопатическая форма.
Этиология конституциональной Г. а. (синдрома, или анемии, Фанкони, парциальной Г. а. Джозефса — Даймонда — Блекфена и семейной Г. а. Эстрена — Дамешека) связана скорее всего с наследованием гена от одного из родителей по рецессивному типу. При цитогенетическом исследовании Блум (G. Е. Bloom) с сотр. (1966) обнаружили у больных разнообразные хромосомные аберрации в кроветворных клетках. Описаны случаи заболевания детей, родившихся от межродственных браков. Некоторые авторы отмечают сходство синдрома Фанкони с эмбриопатией (см.), вызванной талидомидом (см.).
Причины
Причины апластической анемией следующие:
- Наличие внешних факторов, которые обладают миелотоксическим эффектом, то есть провоцируют цитостатические нарушения свертываемости крови. Сюда относятся и различные заболевания инфекционной и вирусной природы, и действие ионизирующего излучения, и некоторые лекарственные препараты (анальгин, противотуберкулезные препараты, некоторые виды антибиотиков), а также препараты, применяемые в химиотерапии.
- Эндогенные, то есть внутренние, причины апластической анемии – накопление токсических веществ в результате внутренних нарушений и эндокринных сдвигов, например, в случае развития гипотериоза, уремии.
- Аутоагрессия, когда у больного развивается индивидуальная чувствительность к антигенам и появляются антитела в крови.
- Идиопатические формы апластической анемии. Различают у половины больных, диагностируют в случае, если установить причину развития заболевания не удалось.
Основные факторы апластической анемии
На современном этапе специалистам удалось изучить в наибольшей степени только врожденные виды апластических анемий. Так, в случае диагностирования анемии Фанкони причина заключается в изменениях в парных хромосомах I и VII. При анемии Даймонда – Блекфена мутируют гены хромосом I, XVI, XIX, и XIII. Свою роль в этих процессах может сыграть воздействие на организм свободных радикалов.
Патогенез
Развитие Гипопластической анемии может быть связано либо с повреждением стволовой клетки, родоначальной для грануло-, эритро- и тромбоцитопоэза, либо с дефектом ее микроокружения (см. Кроветворение), препятствующим нормальной жизнедеятельности этой клетки. Обнаружение хромосомных аберраций при врожденной Г. а., лечебная эффективность трансплантации костного мозга от однояйцовых близнецов, а также малое количество стволовых клеток, выявляемое при культивировании костного мозга больных, подтверждают первое предположение. Редкость возникновения Г. а. под влиянием перечисленных факультативных факторов говорит о роли индивидуального, возможно наследственного, предрасположения. Участие аутоиммунных механизмов предполагается только при парциальной Г. а., при к-рой Крантц (S. В. Krantz, 1973) и Л. И. Идельсон с сотр. (1976) обнаружили антитела к ядрам эритроцитов. Ок. 50% случаев парциальной Г. а. развивается у больных, страдающих доброкачественной тимомой; причины этого пока неясны. При Г. а. дефицита факторов кроветворения не наблюдается. Напротив, содержание их в крови даже повышено вследствие неполного использования уменьшенной по объему эритропоэтической ткани.
Геморрагические проявления при Г. а. обусловлены нарушением гемостаза в результате глубокой тромбоцитопении и поражения сосудистой стенки. Повышенная проницаемость сосудистой стенки носит вторичный характер и связана с гипоксией, недостатком серотонина. Гистохим, и иммуноморфо л. исследования выявляют глубокие структурные нарушения в сосудистой стенке.
Железодефицитная анемия
Исходя из названия патологии, становится понятным, что возникает в результате острой нехватки указанного элемента в организме человека. Причиной того, почему образовывается железодефицитная патология, может быть продолжительная потеря крови (менструальные выделения, язвенные очаги, т. п.). Часто диагностика беременных девушек обнаруживает наличие такого заболевания в силу высокой необходимости в микроэлементе на этом жизненном этапе. Железодефицитная при исследовании в лаборатории показывает низкий гемоглобин, также эритроциты и железо в малом количестве. Лечится железодефицитная, посредством использования медикаментов с высоким содержанием железа, перорально или в виде уколов. Расшифровка при ЖДА покажет нарушение морфологической особенности эритроцита и их индекса. Также отличается анизоцитозом – когда эритроциты одного человека отличаются размером друг от друга. Кроме того, патология характеризуется пойкилоцитозом – различие форм эритроцитов одного пациента.
Прогрессирующая железодефицитная во время биохимического обследования крови выявляет сывороточный ферритин довольно низкий, железо в низком количестве, завышенное ОЖСС, трансферрин мало насыщен железом. Железодефицитная имеет три стадии развития: легкая, средняя, тяжелая. При подобном заболевании легкой формы гемоглобин находится в заниженном положении, но выше 88 г/л. Средней формы тяжести удерживает гемоглобин на отметке 72г/л. При тяжелом развитии, она снижает концентрацию гемоглобина ниже 69г/.
Патологическая анатомия
На вскрытии обнаруживают признаки малокровия и дистрофии внутренних органов, обильное отложение жира в подкожной клетчатке, эпикарде, сальнике, множественные геморрагии в коже, слизистых оболочках, серозных покровах, внутренних органах. Иногда отмечают массивные кровоизлияния в головной мозг или мышцу сердца, являющиеся непосредственной причиной смерти. Костный мозг плоских костей бледно-розового или желтоватого цвета, иногда с темнокрасными участками кровоизлияний. При сдавлении кости с поверхности разреза стекает кровянистая жидкость, богатая жиром. Среди жирового костного мозга могут наблюдаться участки сохранившейся кроветворной ткани. Размеры селезенки и лимфатических узлов часто уменьшены.
Рис. 1. Микропрепарат печени (гипопластическая анемия): стрелкой указано отложение гемосидерина. Рис. 2. Микропрепарат почки (гипопластическая анемия): стрелками указано отложение гемосидерина в эпителии канальцев.
При микроскопическом исследовании костного мозга (см.) выявляется различная степень его опустошения. В случае аплазии в жировом костном мозге находят лишь небольшие скопления лимфоцитов, плазматических клеток и недифференцированных элементов, единичных гранулоцитов и нормобластов. При гипоплазии несколько чаще обнаруживают участки кроветворной ткани. Характерна неравномерность распространения очагов кроветворения не только в различных участках скелета, но и в пределах одной и той же кости. Структура костной ткани чаще сохранена. Как для ранних, так и для поздних фаз болезни характерно отложение гемосидерина в селезенке, печени (рис. 1) и костном мозге, реже в почках (рис. 2), лимф, узлах.
К частым осложнениям Гипопластической анемии относят фибринозно-геморрагические пневмонии и некротические изменения в слизистых оболочках и серозных покровах, коже, внутренних органах.
Диагностика
Осмотр пациента — один из начальных моментов диагностики
Диагностика начинается с конкретизации симптоматики и анамнеза. Производится физикальное обследование, во время которого врач осматривает слизистые, полость рта, состояние кожи, ногтей, волос. Назначается общий анализ крови, который необходимо будет повторить, прежде чем начинать лечение.
- При диагностике клинического анализа учитывается число форменных элементов крови, их характеристики и соотношение; уровень гемоглобина.
- Биохимический анализ крови позволяет определить значения сывороточного железа, общую железосвязывающую способность сыворотки, характеристики трансферрина. Также изучаются показатели белка, билирубина, трансаминазы, магния, натрия, кальция, калия, мочевины, креатинина.
- Анализ мочи исследуется на наличие эритроцитов, уровень лейкоцитов и белка.
- Диагностика образца костного мозга выявляет количество очагов кроветворения, состояние кроветворной ткани.
- Дополнительно пациента могут направить на УЗИ брюшной полости, рентгенографию грудной клетки.
Течение и симптомы
Заболевание может протекать остро, подостро или хронически. В острых случаях процесс начинается с бурного геморрагического диатеза (см. Геморрагические диатезы), тяжелой общей интоксикации, инфекционных осложнений. Чаще наблюдается постепенное нарастание симптомов. Появляются адинамия, слабость, головокружение, быстрая утомляемость, одышка при физ. нагрузке, иногда боли в костях и области сердца. Отмечается восковидная бледность кожи без желтушности, малокровие видимых слизистых оболочек. Подкожная жировая клетчатка сохранена. При развитии глубокой тромбоцитопении (см.) возникают кровоизлияния на коже, слизистых оболочках и глазном дне, носовые, десневые, маточные, кишечные, почечные и другие кровотечения. При прогрессировании процесса может иметь место неврологическая симптоматика, обусловленная геморрагиями в головной мозг. При парциальной Г. а. кровоточивость отсутствует. Размеры лимфатических узлов, селезенки и печени не изменяются.
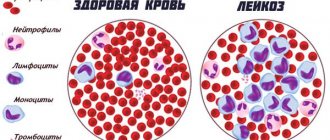
Картина крови. Анемия носит нормохромный, нормоцитарный, реже макроцитарный характер. Полихроматофилия отсутствует, число ретикулоцитов нормально или снижено. Лейкопения может достигать 1000 клеток в 1 мкл и менее; она обусловлена в основном гранулоцитопенией и сопровождается относительным лимфоцитозом. Абсолютное число лимфоцитов при резкой лейкопении также снижено. Отмечается тромбоцитопения с удлинением времени кровотечения (см.) и снижением ретракции кровяного сгустка (см. Ретракция). Плазменные факторы свертывания крови (см. Свертывающая система крови) не изменяются. Содержание сывороточного железа повышено, общая железосвязывающая способность сыворотки чаще повышена.
Парциальная Г. а. характеризуется хрон, нормоцитарной анемией, часто без лейко- и тромбоцитопении, с глубокой ретикулоцитопенией.
Пунктат костного мозга, как правило, скудный, ядерные элементы представлены в основном лимфоцитами, немногочисленными гранулоцитами и нормобластами. Мегакариоциты чаще отсутствуют. Иногда, несмотря на явную панцитопению, пунктат оказывается довольно богатым; это связано с попаданием иглы в очаг сохранившегося кроветворения. Помимо чисто количественного дефицита эритробластических элементов, при Г. а. отмечают признаки качественной их патологии (дизэритропоэз), мегалобластоидность, атипичные митозы, многоядерность (см. Дизэритропоэтическая анемия). При парциальной Г. а. пунктат костного мозга богат ядерными элементами, лейко-тромбоцитопоэз не нарушен, но число клеток красного ряда нередко резко уменьшено или они полностью отсутствуют.
Рис. 3. Микропрепарат костного мозга подвздошной кости (гипопластическая анемия): резкое преобладание жирового костного мозга над кроветворным. Костномозговые полости заполнены преимущественно жировой тканью, миелоидная ткань представлена маленькими островками черного цвета; х 280.
Трепанобиопсия подвздошной кости выявляет резкое преобладание жирового костного мозга над кроветворным (рис. 3), иногда отсутствие последнего.
Исследование с радиоактивным железом 59Fe дает наиболее точную суммарную оценку эритропоэза: клиренс изотопа из плазмы замедлен, он накапливается в основном в печени, включение метки в эритроциты резко замедлено.
Симптомы
В зависимости от того, насколько выражены нарушения процессов кроветворения, клинические проявления и симптомы апластической анемии очень разнообразны: различают переходные формы апластической анемии от частичного угнетения процессов образования клеток крови до выраженного недоразвития костного мозга.
В течении заболевания выделяют 3 основных синдрома апластических анемий:
- цитопенический;
- септико – некротический;
- геморрагический.
Эти синдромы анемии могут по-разному проявляться в организме человека в зависимости от степени развития заболевания. Различают 3 этапа развития болезни, при этом симптомы апластической анемии на каждом из них разнятся.
I этап характеризируется проявлением неспецифических симптомов, которые могут быть при любом другом патологическом процессе, — хроническая усталость и общая слабость. Очень часто больные приспосабливаются к существующей у них анемии и обращаются к специалисту только тогда, когда заболевание начнет прогрессировать. Также этот этап характеризуется такими проявлениями геморрагического синдрома, как маточное, носовое кровотечение и повышенная склонность к образованию кровоподтеков (синяки на теле без причины).
На II этапе у больных болеющие апластической анемией отмечается бледность кожи и видимых слизистых оболочек, также иногда могут возникать кровоподтеки. Если заболевание переходит в острую форму, помимо бледности кожных покровов также наблюдают геморрагический шок, некроз слизистых оболочек и высокую температуру. В организме активизируются различные воспалительные процессы (в частности, пневмония).
Обычно печень и селезенка не увеличиваются, но если диагностируют аутоиммунную форму апластической анемии, при которым в организме больного вырабатываются антитела к эритроцитом, может развиться умеренная спленомегалия (увеличение селезенки) и легкая желтушность кожи и склер, вызванных наличием в крови гемолитических компонентов.
Геморрагические высыпания
Показатели в анализе крови
Наиболее ярко выраженным является III этап анемии, который характеризируется бурной картиной клинических проявлений. На этой стадии развития апластической анемии анализ крови показывает:
- в клиническом анализе крови определяется ярко выраженная анемия (как правило, нормохромная) – уровень гемоглобина уменьшается до 20 – 30 г/л, концентрация ретикулоцитов снижается (говорит о снижении функциональности костного мозга);
- возникает лейкопения, гранулоцитопения, то есть резко снижается уровень содержания в крови гранулярных лейкоцитов. При этом количество лимфоцитов не изменяется;
- понижение тромбоцитов, вплоть до нуля;
- при гистологическом исследовании ткани костного мозга отмечается катастрофическое исчезновение его клеток, которые замещаются жировой тканью;
- резко повышается СОЭ – до 30 – 50 мм/час;
- в сыворотке крови концентрация железа увеличивается.
Осложнения
Основными осложнениями и непосредственной причиной смерти больных являются кровотечения и инфекционно-воспалительные процессы. Геморрагии выявляются при снижении числа тромбоцитов ниже критического уровня (20 000—30 000 в 1 мкл), могут провоцироваться даже незначительными травмами (подкожные инъекции и т. д.). Инфекции (пневмонии и др.) развиваются при достаточно длительном и выраженном (менее 500 в 1 мкл) снижении числа нейтрофилов.
Всякая лихорадка у больных Г. а., как правило, связана с наличием инфекционного очага; описано немало случаев развития у них острого лейкоза. Лейкозы на фоне гипоплазии лучевого или бензольного происхождения относятся к группе миелобластных или миеломонобластных и являются, видимо, поздним результатом лейкемогенного действия фактора, вызвавшего анемию. Значительно реже наблюдается присоединение к Г. а. пароксизмальной ночной гемоглобинурии, хотя некоторые авторы трактуют в этих случаях Гипопластическую анемию как гипопластическую стадию данной формы гемолитической анемии.
Анализы крови при апластической анемии
При апластической анемии анализ крови может многое рассказать, как и при любой другой форме этого заболевания. Чаще всего встречается дефицит железа, из-за чего анемия именуется железодефицитной. В целом под ней понимается заболевание, которое провоцирует дефицит железа или неправильный процесс его переработки внутри организма.
Железодефицитной анемии диагностика подтверждает, что первичным заболеванием она считаться не может. Присутствует дополнительное патологическое влияние.
Дефицит железа в организме становится причиной неправильного кроветворения. Из-за железодефицита происходит неправильный гемоглобиновый синтез на базе эритроцитов.
В результате количество их становится меньше, как и функциональные способности.
Диагностика анемии демонстрирует, что именно железодефицитный вариант является наиболее распространенным в мире. Чаще всего сталкиваются с ЖДА женщины, в том числе из-за беременности и кормления грудью. Кроме этого, они периодически теряют кровь, что снижает количество железа.
Проведение анализа
Анализ крови при анемии является обязательным исследованием. При этом предлагается три варианта:
- общий кровяной анализ;
- биохимия;
- анализ кала на скрытую кровь.
Рекомендации врачей говорят о том, что лучше пройти все обследования, а не выбирать какое-то одно. Говоря об общем анализе крови, показатели, определяемые при нем, помогают понять, в каком состоянии находятся все кровяные клетки. ОАК демонстрирует соотношение их объемного показателя к жидкой кровяной части. Кроме этого, определяются гемоглобиновые показатели, формула по лейкоцитам.
Какие существуют анализы крови?1899
Биохимия – это лабораторная диагностика, помогающая понять, в каком состоянии находятся системы и внутренние органы.
Такое исследование помогает определить и недостаток железа в организме, причем не только выраженный, но и скрытый, за счет определения уровня ферритина и трасферрина. Первый компонент демонстрирует, сколько в организме осталось железистых запасов.
Кроме этого, демонстрируются другие показатели, сдвиги которых могут объясняться нехваткой железа.
В рамках сдачи кала на скрытую кровь можно проанализировать присутствует ли в желудке и кишечнике кровотечение. Важно отметить, что такая лабораторная диагностика предполагает особую подготовку. Речь идет об исключении из рациона за три дня до сдачи продуктов с высоким содержанием железа и медикаментов, которые предназначены для восполнения этого недостатка.
Стоит сразу отметить, что большинство анемий поддаются корректировке, особенно, если выявляются на ранней стадии. Чтобы анализы при анемии продемонстрировали правильные цифры, важно подготовиться к ним правильно. Об особенностях подготовки к сдаче калатуже упоминалось выше.
Если говорить про анализ крови при железодефицитной анемии, то здесь все несколько проще. За сутки до сдачи исключается прием любого напитка, содержащего алкоголь. Сдача крови выполняется в утренние часы после предварительного восьмичасового голодания.
В этот период запрещено употреблять любую пищу или напитки, кроме негазированной воды. По согласованию с врачом исключаются любые лекарственные препараты, кроме жизненно необходимых. Препараты, в которых содержится железо, должны быть исключены за трое суток до анализа. Курение исключается за полчаса до сдачи.
Важно исключить перенапряжение с физической и эмоциональной точки зрения.
Какие анемии бывают
Выше уже отмечалось, что анализы на анемию бывают разные, так как существуют разные типы заболевания. В большинстве случаев выполняется постановка диагноза железодефицитная анемия. В организме присутствует дефицит железа.
Это может быть результатом недостаточного поступления его вместе с пищей, или результатом неправильной переработки его в организме или длительное кровотечение. Анализу и предстоит определить причину, в соответствии с которой подбирается лечение.
Часто такая картина крови наблюдается у беременных или кормящих матерей, в такие моменты железо потребляется организмом в большом количестве, поэтому до анемического состояния дойти не сложно.
Чтобы дифференцировать такое состояние, обратите внимание на гемоглобин, он в таком случае демонстрируется недостаточный, сокращается эритроцитный показатель и уровень железа в сыворотке. Лечение ЖДА, называющейся также малокровием, предполагает прием железа по длительной схеме.
Встречается и гемолитическая анемия. В таком случае болезнь развивается на фоне гемолиза – эритроцитного разрушения в крови. Способствовать этому могут различные факторы. Как пример, отравление ядами, сильные нагрузки стрессового характера, болезни, передающиеся по наследству.
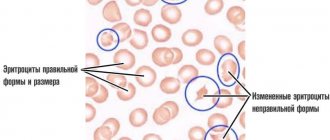
Для такого диагноза выполняется расшифровка анализа мочи, в которой обнаруживается гемоглобин. В крови растет показатель билирубина. Иногда присутствуют эритроциты измененной формы и другие признаки. На основе гемограммы выясняется первопричина, которую и нужно лечить.
В12 дефицитная анемия или по-другому пернициозная анемия встречается в том случае, когда фиксируется недостаток витамина В 12. Без этого витамина невозможен рост и созревание эритроцитов в костном мозге. Кроме этого, без него невозможна правильная работа системы нервной направленности.
Пернициозная анемия часто проявляет себя как покалывание и онемение, присутствующее в пальцах, походка становится шаткой. В анализах пернициозная анемия проявляет себя как повышенное количество эритроцитов с увеличенной формой.
Пернициозная анемия часто встречается у пожилых людей. Можно встретить и еще одно ее название – мегалобластная анемия. Недостаточное количество В12 фиксируется при заболеваниях пищеварительного тракта, при присутствии в организме таких паразитов, как ленточные черви.
Все это провоцирует диагноз мегалобластная анемия.
Еще немного о видах анемий
Встречается и так называемая злокачественная анемия, именуется которая апластической.
Под такими формами анемии понимается особая группа заболеваний крови, в результате чего количество всех клеток крови снижается, а признаки опухолевого процесса отсутствуют.
Это не слишком распространенное заболевание, однако поражать оно может представителей всех полов и возрастов, но чаще встречается у старшей возрастной группы. Пробелам апластической анемии заключается в том, что как минимум две трети заболевших не выживают.
Еще одна необычная форма – это серповидноклеточная анемия. Она становится следствием наследственного заболевания кровяной системы.
Речь идет о дефекте, работающем на уровне генетики, в результате которого происходит нарушение формирования нормальных гемоглобиновых цепей в рамках эритроцитов.
Гемоглобин, который образуется при этом, является аномальным, есть у него отличия и по свойствам электрофизиологического типа, если сравнивать с нормальным здоровым гемоглобином.
В результате этого процесса фиксируют изменения самих эритроцитов, которые становятся вытянутыми в длину. Среди наследственных гемоглобинопатий СКА считается наиболее тяжелой формой. Дело в том, что эритроциты с таким изменением подвергаются быстрому разрушению в организме, часто вызывают осложнения тяжелого течения и смерть.
Гипохромная анемия – это общее название для целой группы заболеваний, на фоне которых недостаточность гемоглобина приводит к формированию другого цветового показателя крови.
Расшифровка анализа в таком случае демонстрирует цифру менее 0,8, а концентрация гемоглобина в одном эритроците не дотягивает до 330 г/л. Чаще всего гипохромная анемия формируется вслед за ЖДА. Кроме этого, привести к такому диагнозу может отравление свинцом хронического порядка, недостаток витамина В6.
Столкнуться с ней можно после некоторых воспалений инфекционной и неинфекционной природы, которые приводят к нарушению железистого обмена.
Причины ЖДА
Если при дифференциальной диагностике железодефицитной анемии был подтвержден диагноз, важно выявить причину патологии. Выше уже отмечалось, что провоцировать ЖДА может как недостаток железа с пищей, так и неправильная его переработка организмом.
Кроме этого, нельзя исключать повышенные в количестве железа потребности организма, врожденный его недостаток, нарушение процессов всасывания или синтеза трансферрина. Влияют негативно массивные кровопотери, алкоголизм, прием ряда медикаментов.
Если говорить о недостатке железа, поступающего с пищей, то чаще всего наблюдается такая проблема при длительном голодании, у вегетарианцев, при однообразных диетах, не предполагающих большое количество животных продуктов.
Повышенная в железе необходимость является нормальным признаком, если речь идет о беременных или кормящих матерях. В такие периоды количество его с пищей должно увеличиваться. При этом если речь идет о многоплодной беременности, то цифры потребления железа должны увеличиваться еще в несколько раз.
Дети, страдающие от врожденного железистого дефицита, рождаются у матерей с тяжелой железодефицитной анемией, при многоплодной беременности или недоношенности. В таком случае с симптомами ЖДА ребенок сталкивается уже на первых неделях жизни.
Когда речь идет о неправильном всасывании железа, подразумевается работа двенадцатиперстной кишки, а именно проблемы со слизистой этого кишечного отдела. Самые разные заболевания ЖКТ становятся причиной поврежденной слизистой, что влияет на скорость, с которой железо всасывается.
Это и ряд наследственных заболеваний, в том числе целиакия, которая подразумевает непереносимость глютена. Это может быть воспаление слизистой, которая покрывает тонкий кишечник, инфекционные проблемы, гастрит атрофического типа, в результате которого сокращаются размеры слизистой, что снижает функционал.
Нельзя исключать и гастрит аутоимунного типа. Заболевание провоцируется нарушением иммунной работы и антительным производством.
Атакуют они при этом собственные организменные клетки, в частности, клетки, которые покрывают слизистую желудка, на фоне чего они разрушаются.
Такой диагноз может быть поставлен и людям, перенесшим удаление желудка или части тонкого кишечника. Нельзя исключать болезнь Крона, муковисцидоз и раковые проблемы.
Когда речь идет о неправильном синтезе трансферрина, то в большинстве случаев такие проблемы провоцируются разного рода наследственными заболеваниями.
Трансферрин отвечает за перенос железа к различным органам, в результате страдает и красный костный мозг, так как синтезироваться эритроциты не могут.
За синтез трансферрина отвечают печеночные клетки, поэтому их разнообразные поражения, могут стать причиной сокращенного количества трансферрина, что спровоцирует симптоматику ЖДА.
Повышенная потеря крови тоже может приводить к недостатку железа. При этом чаще всего подразумеваются именно хронические небольшие кровопотери.
Дело в том, что одноразовые, даже массированные потери крови, такой проблемы не вызывают, поскольку в организме железо присутствует в виде запасов, которые и предназначены для возмещения таких потерь.
Когда же речь идет о хронических кровотечениях внутри, которые незаметны сразу, длятся которые долго, человек может терять по миллиграмму железа каждый день и так на протяжении долгого времени.
Хроническая кровопотеря может формироваться на фоне язвенной болезни желудка или двенадцатиперстной кишки, геморрой, неспецифического язвенного колита, болезни Крона, кишечного полипоза.
Влияют таким же образом опухоли ЖКТ, эндометриоз, системная красная волчанка. С таким диагнозом могут столкнуться и слишком активные доноры, которые в год сдают кровь более четырех раз.
Важно обнаружить непосредственную причину кровопотери, в противном случае ЖДА для больного неизбежна.
Алкоголизм тоже не лучший друг железа. При длительном и частом употреблении алкогольных напитков повреждается слизистая желудка. Кроме этого, этиловым спиртом угнетаются процессы кроветворения, которые проходят в красном костном мозге, что усиливает анемичные проявления.
Нельзя в качестве причин появления ЖДА исключать и прием определенных медикаментов. Дело в том, что у некоторых лекарственных препаратов, нарушение процессов всасывания и железистой утилизации является побочным эффектом. Чаще всего столкнуться с такой проблемой можно при длительном курсе лечения с большими дозами препарата.
Что показывает при беременности общий анализ крови?34404
Повлиять на уровень железа могут такие популярные препараты, как противовоспалительные нестероидные средства. Дело в том, что такие препараты как бы разжижают кровь, что чревато образованием хронических внутренних кровотечений. Кроме этого, опасен их бесконтрольный прием язвенной болезнью желудка.
В группу опасных, с этой точки зрения, препаратов входят и антациды, которые сокращают или нейтрализуют скорость выделения желудочного сока. В составе его присутствует соляная кислота, которая требуется для нормального всасывания железа.
Препараты железосвязывающего характера помогают в связке и выводе железа из организма. При этом речь идет не только о свободном железе, но и о запасах организма.
Говоря о симптоматике анемии, связанной с дефицитом железа, чаще всего врачами обращается внимание на бледность кожи и губ, слабость, утомляемость.
На фоне недостаточности кислорода в крови повышается пульс, который превышает показатель в 90 ударов в минуту. Признаки могут варьироваться, в зависимости от вида анемии, которая вас настигла.
Источник: https://1diagnos.ru/laboratornye-issledovaniya/aplasticheskaya-anemiya.html
Диагноз
Диагноз основывается на наличии панцитопении и бедного ядерными клетками пунктата или трепаната костного мозга при отсутствии увеличения лимф, узлов, селезенки и печени. Г. а. следует дифференцировать гл. обр. с панцитопениями другого происхождения. Обнаружение в крови молодых клеток белого или красного ряда, даже незначительное увеличение селезенки всегда должны вызывать сомнение в диагнозе Г. а. В этих случаях можно предположить наличие алейкемических форм лейкозов (см.), раковых метастазов в костный мозг, миеломной болезни (см.). Диагноз обычно ставят на основании исследования пунктата костного мозга; миеломной болезни, кроме того, присущи характерные изменения белков сыворотки и (или) мочи. Панцитопения при миелофиброзе (см. Остеомиелофиброз) сопровождается, в отличие от Г. а., увеличением и миелоидной метаплазией селезенки. Анемию Аддисона — Бирмера (см. Пернициозная анемия) отличает от Г. а. наличие глоссита, неврол, нарушений, ахлоргидрии, выраженного мегалобластоза костного мозга, хорошего терапевтического эффекта от витамина B12. Диагноз пароксизмальной ночной гемоглобинурии даже в ее ранней, гипопластической, стадии подтверждается положительными результатами сахарозной и кислотной проб (см. Гемолитическая анемия). При подостром варианте лимфогранулематоза (см.) панцитопения сопровождается лихорадкой, нет резкого лимфоцитоза, в трепанате костного мозга иногда удается обнаружить клетки Березовского — Штернберга. Панцитопения вследствие гиперспленизма сопровождается, как правило, увеличением селезенки.
Лечение гипопластической анемии
Лечебная тактика зависит от причины анемии
- В первую очередь устраняют причину заболевания (прекращение приёма лекарственных средств, взаимодействия с токсическими веществами).
- При аутоиммунных формах назначаются глюкокортикоидные лекарственные препараты. В тяжелой стадии наилучший результат достигается при удалении селезёнки. Также существует новый метод, доказавший свою эффективность — полная замена иммунных клеток.
- При наличии вирусных инфекций, вызвавших гипопластическую анемию, лечение может заключаться в приёме противовирусных, антибиотиков (если присутствует бактериальное присоединение), глюкокортикостероидов (при осложнениях различного характера).
- При интоксикации от взаимодействия с токсическими веществами назначаются лекарственные средства, прекращающие действие яда на организм — антидоты.
- Общее назначение при лечении гипопластической анемии — трансфузия. При снижении отдельных показателей кровяных клеток может осуществляться переливание только эритроцитарной, тромбоцитарной, лейкоцитарной массы. Исключение — аутоиммунная анемия.
- Приём средств, восстанавливающих кроветворение. Например, цианокобаламина — препарата, способствующего созреванию эритроцитов, активизации тромбоцитов.
- Пересадка костного мозга — единственный результативный способ реанимировать функцию костного мозга при крайне тяжёлых формах заболевания.
Лечение
Методов радикального излечения Гипопластической анемии не существует, однако лечебные мероприятия способствуют удлинению продолжительности жизни больных. При выявлении этиол, фактора необходимо прекратить дальнейшее его воздействие. Для борьбы с анемией показаны трансфузии крови или эритроцитарной массы; эта мера не должна преследовать цель полной нормализации показателей красной крови — достаточно поддержание их на уровне, совместимом с сердечно-сосудистой компенсацией. Число трансфузий должно быть минимальным для уменьшения опасности трансфузионного сидероза (при переливании 450 мл крови в организм вводится 200—250 мг железа), гепатита и других осложнений. Во избежание изосенсибилизации антигенами лейкоцитов и тромбоцитов целесообразно переливать отмытые эритроциты. При многократных гемо-трансфузиях нередко развитие изосенсибилизации антигенами эритроцитов; в этих случаях кровь для трансфузии подбирают по непрямой пробе Кумбса (см. Кумбса реакция).
В случае сочетания анемии с геморрагическим диатезом показаны переливания свежецитратной крови или прямые гемотрансфузии в разовой дозе не менее 500 мл. Более выраженным гемостатическим эффектом обладают тромбоцитарные концентраты, получаемые с помощью сепаратора клеток крови от одного донора или путем центрифугирования большого числа доз крови, взятых от различных доноров. Кровоостанавливающее действие тромбоконцентратов проявляется в том случае, если число тромбоцитов у больного удается повысить хотя бы до 15 000 —20 000 в 1 мкл крови. При многократных переливаниях тромбоцитарных концентратов, особенно полученных из крови разных доноров, неизбежно развивается изосенсибилизация к тромбоцитарным антигенам и отмечается снижение терапевтической эффективности трансфузий. Поэтому желательно в качестве доноров использовать ограниченное число лиц, лучше родственников, максимально совместимых по антигенам системы HL — А (см. Группы крови, лейкоцитарные антигены).
Среди лекарственных препаратов свойством стимулировать эритропоэз обладают лишь анаболические стероиды (см.). Необходимым условием достижения терапевтического эффекта считают длительность применения гормонов в достаточно высокой дозе (напр., метилтестостерон или неробол по 1—2 мг на 1 кг веса тела в день внутрь в течение 3—4 мес.) [Мак-Креди (К. В. McCredie), 1969]. Первым проявлением леч. эффективности препаратов может быть улучшение показателей периферической крови. При появлении признаков побочного действия (задержка жидкости, поражение печени) гормоны отменяют. Для лечения Г. а. применяют также кортикостероиды (преднизолон 0,5—1,0 мг на 1 кг веса тела или эквивалентные дозы других стероидов) гл. обр. с целью гемостатического действия (понижение сосудистой проницаемости); для этого используют и другие, так наз. сосудоукрепляющие средства — аскорбиновую к-ту, рутин, препараты кальция. С целью уменьшения гемосидероза органов и тканей можно назначать препараты типа десферала.
Многочисленные попытки пересадки больным донорского костного мозга, предпринимавшиеся без должного иммунологического подбора (только по основным эритроцитарным антигенам), оказались безуспешными, т, е. завершились отторжением трансплантата вследствие биол, несовместимости. Случаи подлинной трансплантации немногочисленны. Томас (E. D. Thomas) с сотр. (1974) осуществили у четырех больных Г. а. успешную пересадку сингенного костного мозга, полученного от однояйцевых близнецов больных, приведшую к полному выздоровлению; операция проводилась без специальной подготовки ввиду антигенной идентичности реципиентов и доноров. Однако подобная возможность является казуистической. Аллогенные пересадки (от доноров, совместимых по системе Hl—А ) требуют сложной подготовки реципиентов для предотвращения отторжения трансплантата (общее облучение или введение циклофосфан с целью иммунодепрессии), а также послеоперационного применения цитостатиков для подавления иммунол, реакции «трансплантат против хозяина» (см. Несовместимость иммунологическая). Из 24 больных Г. а., описанных Томасом с сотр., 12 прожили св. 3 мес.; приживление у них трансплантата было доказано в результате анализа полового хроматина (см.). У больных, получивших ранее многочисленные гемотрансфузии, шансы на приживление трансплантата в связи с образованием изоантител снижаются. Сложность методики пересадки костного мозга делает ее доступной лишь для отдельных специализированных учреждений.
Вопрос об эффективности спленэктомии окончательно не решен. При выраженных геморрагиях операция противопоказана в связи с высокой летальностью. Вероятно, более целесообразна спленэктомия (см.) у больных с повышенной секвестрацией тромбоцитов и эритроцитов в селезенке, доказанной радиоизотопным методом, и при сохранности очагов нормального кроветворения в костном мозге.
Фолиеводефицитная анемия
Общее обследование выявляет пониженное состояние эритроцита. В диаметре этот микроэлемент будет составлять более 12 мкм. Также фолиеводефицитная характеризуется ретикулопенией, понижением тромбоцита и лейкоцита. Кроме указанных проявлений, фолиеводефицитная патология вызывает лимфоцитоз. СОЭ повышает свою интенсивность. Фолиеводефицитная патология входит в подгруппу мегалобластной. Из-за низкого процента фолиевой кислоты деление зрелых кровяных клеток останавливается, развивается фолиеводефицитная.
Гиперхромная группа заболевания характеризуется пониженным количеством эритроцитов. При этом гемоглобиновый уровень практически не изменяется. Следовательно, эритроциты испытывают избыток этого вещества. Поэтому она вызывает насыщеный красный цвет эритроцитов. Диагностированная гипохромная провоцируется пониженным уровнем гемоглобина в эритроцитах. Диагностика заболевания приходит в лабораторных условиях. Расшифровка анализа крови помогает определить, присутствует ли она у пациента. Для этого необходимо определить соотношение эритроцитов, показатель гемоглобина и цвета.
Автор:Е.Кубина
Профилактика
Лица, профессионально связанные с воздействием миелотоксических факторов (источники ионизирующей радиации, бензольное производство), должны находиться под постоянным диспансерным наблюдением. Проведение цитостатического лечения по поводу опухолей и других заболеваний требует регулярного контроля состава крови и своевременного прекращения при угрозе гипоплазии кроветворения. Применение потенциально опасных препаратов, в первую очередь левомицетина (см.), должно быть ограничено прямыми показаниями и находиться под контролем состава крови. Профилактика геморрагий при уже развившейся Г. а. включает гормональное подавление менструального цикла у женщин с массивными меноррагиями, замену (по возможности) инъекционных лечебных препаратов пероральными, щажение слизистых оболочек (исключение грубой пищи, замена жестких зубных щеток ватными тампонами). Для предотвращения инфекционных осложнений при глубокой гранулоцитопении (см. Лейкопения) рекомендуется подавление кишечной аутофлоры неабсорбируемыми антибиотиками, больных следует содержать в асептических или близких к ним условиях, следить за соблюдением личной гигиены.
Механизм развития анемии
Анемия – синдром, характеризующийся резким уменьшением количества гемоглобина в крови. Как известно, благодаря гемоглобину происходит перенос кислорода от легким к тканям. Гемоглобин, в свою очередь, входит в состав красных кровяных телец – эритроцитов, синтезирующихся в костном мозге из гемопоэтических стволовых клеток.
При апластической анемии костный мозг прекращает производство новых эритроцитов или резко снижает их выработку. Связано это с уменьшением количества гемопоэтических стволовых клеток или с нарушением их функциональности.
Обычно снижается выработка не только эритроцитов, но и иммунных клеток – лейкоцитов, а также тромбоцитов, отвечающих за свертывание крови. Возникает состояние, которое называется пангемоцитопенией. Таким образом, при апластической анемии прекращается или серьезно снижается выработка всех основных клеток крови, что представляет серьезную угрозу для жизни. Ведь эритроциты живут в крови всего три месяца, тромбоциты – 1-2 недели, а лейкоциты – не больше дня.
Основные показатели анализа крови и их значения, указывающие на анемию
На начальном этапе для определения наличия какой-либо анемии сравнивают основные показатели анализа крови с референсными значениями. Основные значения исследуемых величин представлены в таблице:
| Пациенты | Гемоглобин, г/л (HB) | Эритроциты, млн/мкл (RBC) | Цветовой показатель | Ретикулоциты, % (RTC) |
| Мужчины | 130 – 160 | 3,8 – 5,6 | 0,83 – 1,05 | 5,1 – 18,0 |
| Женщины | 120 – 140 | 3,7 – 5,3 | 5,0 – 17,0 | |
| Подростки (14-18 лет) | 125 – 145 | 3,7 – 5,2 | 0,9 – 1,0 | 4,8 – 18,0 |
| Дети (10-14) | 120 – 140 | 3,8 – 5,0 | 4,8 – 18,0 | |
| Дети (5-10) | 110 – 135 | 3,9 – 5,1 | 4,8 – 18,0 |
Уровень гемоглобина
Это основное красящее вещество, входящее в состав эритроцитов, которое отвечает за перенос кислорода. Пониженная составляющая гемоглобина указывает на наличие малокровия различной этиологии.
На основании показателей количественного отклонения гемоглобина от референсных значений выявляют характер протекания анемии по степени интенсивности:
- лёгкая – содержание гемоглобина от 110-90 г/л;
- средняя – от 90-70 г/л;
- тяжёлая – менее 70 г/л.
Определить характер и возможные причины, вызывающие анемию, помогают и другие показатели.
Эритроциты
Красные безъядерные кровяные клетки, которые имеют форму диска. Благодаря двояковыпуклой форме эритроциты могут деформироваться, приспосабливаясь к узким капиллярам. Эритроциты доставляют кислород из лёгких ко всем тканям и забирают углекислоту. Низкий уровень этих клеток характеризует любой тип анемии.
Ретикулоциты
Эти клетки представляют собой недозрелую форму эритроцитов. Выявляются в костном мозге, в некотором количестве содержатся в периферической крови. Увеличение доли ретикулоцитов говорит о разрушении эритроцитов, что указывает на прогрессирование анемии. Расчёт ведётся в % отношении от всех эритроцитов. Значение ретикулоцитов помогает оценить степень тяжести заболевания.
Цветовой показатель
Этот показатель нужен для определения степени насыщения гемоглобином кровяных клеток (эритроцитов). Если он ниже нормы, это может указывать на наличие анемии. По значению ЦП различают:
- гипохромную анемию (менее 0,8);
- нормохромную анемию (0,8-1,05);
- геперхромную анемию (свыше 1,05).
Эти данные помогают выявить тип заболевания. Высокий цветовой показатель указывает на фолиеводефицитную и В12 анемию. Нормальное значение ЦП бывает при острой постгеморрагической анемии. Сниженный показатель свидетельствует о дефиците железа.
Для более точной диагностики видов анемии определяют другие неспецифические показатели анализов крови.
Эритроцитарные индексы
МCV
– средний объём эритроцита. Выявленные значения свидетельствуют о наличии таких анемий:
| Тип | Значение MCV | Вид анемии |
| Нормоцитарная | от 80-100 фл | Гемолитические |
| Микроцитарная | менее 80 фл | Железодефицитные |
| Макроцитарная | более 100 фл | Фолиево и В12 дефицитные |