Виды гемостаза
Система свертывания крови состоит из трех основных компонентов:
- собственно свертывающая система — предотвращает и устраняет кровопотерю;
- противосвертывающая система — препятствует образованию тромбов;
- система фибринолиза — растворяет уже образовавшиеся кровяные сгустки.
- тромбоцитарный гемостаз — обеспечивается адгезией (склеиванием) тромбоцитов;
- коагуляционный гемостаз — обеспечивается специальными белками плазмы — факторами системы свертывания крови.
Все эти три компонента должны находиться в постоянном равновесии, чтобы предотвратить закупорку сосудов тромбами, либо, наоборот, высокую кровопотерю.
Гемостаз, то есть остановка кровотечения, бывает двух видов:
Коагуляция
Коагуляция или свертываемость крови — это защитный механизм организма от большой кровопотери. Сегодня примерно половина человечества имеет проблемы с коагуляцией. Именно из-за них возникают такие страшные заболевания как тромбоз, инфаркт, инсульт, обширные кровотечения. Каждый десятый человек погибает в результате несвоевременного лечения данных патологий крови, а каждый второй вообще не подозревает у себя наличия нарушения коагуляции.
Коагуляция представляет собой последовательный ряд процессов, каждый из которых запускает следующий. При сбое на любом этапе свертывания возникает патология, которая препятствует нормальной свертываемости крови. Сегодня ученые выявили основные фазы свертывания крови, это:
- Возникновение протромбина.
- Возникновение тромбина.
- Активация фибрина.
Последней фазой остановки кровотечения является сужение и растворение тромба, который переходит в первоначально жидкое состояние.
Тромбоцитарный гемостаз
Данный вид остановки кровотечения включается в работу первым, еще до активации коагуляционного. При повреждении сосуда наблюдается его спазм, то есть сужение просвета. Тромобоциты активируются и приклеиваются к сосудистой стенке, что получило название адгезии. Далее они склеиваются между собой и нитями фибрина. Происходит их агрегация. Сначала данный процесс обратим, однако после образования большого количества фибрина он становится необратимым.
Данный вид гемостаза эффективен при кровотечении из сосудов малого диаметра: капилляров, артериол, венул. Для окончательной остановки кровотечения из средних и крупных сосудов необходима активация коагуляционного гемостаза, обеспечивающегося факторами свертывания крови.
Почему происходит сворачивание крови
Процесс сворачивания крови является защитной реакцией, которая предупреждает обильную кровопотерю при повреждении сосудов и поддерживает относительно ровный объём крови в организме. В норме процесс тромбообразования запускается в том случае, если происходит изменение в физическом и химическом составе крови. Основой этого процесса является растворённый фибрин, который при кровотечении переходит в форму нерастворимого.
Белок в области повреждения образует сеть, напоминающую тонкие нити, которая задерживает кровяные тельца, формируя сгусток. По мере уплотнения тромба он приводит к стягиванию краёв повреждения.
Коагуляционный гемостаз
Данный вид остановки кровотечения, в отличие от тромбоцитарного, включается в работу несколько позже, необходимо больше времени для прекращения кровопотери этим способом. Однако именно этот гемостаз является наиболее эффективным для окончательной остановки кровотечения.
Факторы свертывания вырабатываются в печени и циркулируют в крови в неактивном виде. При повреждении стенки сосуда они активируются. В первую очередь активируется протромбин, который далее превращается в тромбин. Тромбин же расщепляет крупный фибриноген на более мелкие молекулы, которые на следующем этапе объединяются вновь в новое вещество — фибрин. Сначала растворимый фибрин становится нерастворимым и обеспечивает окончательную остановку кровотечения.
Основные компоненты коагуляционного гемостаза
Как уже было отмечено выше, основными компонентами коагуляционного вида остановки кровотечения являются факторы свертывания. Всего их выделяют 12 штук, каждый из которых обозначается римской цифрой:
Ранее в классификации также присутствовал VI фактор (акцелерин), однако его изъяли из современной классификации, так как он является активной формой V фактора.
Кроме того, одним из важнейших компонентов коагуляционного гемостаза является витамин К. Некоторые факторы свертывания и витамин К находятся в прямой взаимосвязи, ведь этот витамин необходим для синтеза II, VII, IX и X факторов.
Лечение наследственного дефицита факторов свертываемости крови
Согласно существующим стандартам, лечение осуществляется препаратами витамина К (внутрь, парентерально), комплексным концентратом протромбина (ККП), назначаемым в/в и свежезамороженной плазмой (СЗП) в/в. Наилучший же эффект достигается инфузией СЗП, в которой содержатся все факторы свертываемости. Единственный отрицательный момент — увеличение объема циркулирующей крови, что определяет необходимость контроля гемодинамических показателей. Лучше всего применять вирусно-инактивированную СЗП, полученную от нескольких доноров.
Основные лекарственные препараты
Имеются противопоказания. Необходима консультация специалиста.
| 1 | Комплексный концентрат протромбина (Протромплекс 600) — препарат плазменных факторов (II, VII, IX, X) свертывания крови. |
Режим дозирования: вводится в/в. Терапию начинают под контролем специалиста, имеющего опыт коррекции нарушений системы гемостаза. Разовую дозу и кратность введения определяют индивидуально. Расчет дозы по показателям МНО производят следующим образом:
| Исходное значение MHO | Разовая доза препарата из расчета на 1 кг массы тела |
| 2,0-3,9 | 25 МЕ/кг |
| 4,0-5,9 | 35 МЕ/кг |
| ≥ 6,0 | 50 МЕ/кг |
Вопрос о введении повторной дозы препарата решается индивидуально по результатам достигнутого значения МНО и клинической динамики.
| 2 | Витамин К (Викасол) — антигеморрагическое средство. |
Режим дозирования: взрослым внутрь — 15-30 мг/сут, в/м — 10-15 мг/сут. Детям в возрасте до 1 года — 2-5 мг/сут., до 2 лет — 6 мг/сут., 3-4 лет — 8 мг/сут., 5-9 лет — 10 мг/сут., 10-14 лет — 15 мг/сут. Кратность приема — 2-3 раза/сут. Продолжительность терапии определяют индивидуально. При длительном применении Викасола каждые 3-4 дня делают 4-дневный перерыв.
Основные разновидности факторов
Перечисленные выше 12 основных компонентов коагуляционного гемостаза относятся к плазменным факторам свертывания крови. Это означает, что данные вещества циркулируют в свободном состоянии в плазме крови.
Существуют также вещества, которые расположены в тромбоцитах. Они называются тромбоцитарные факторы свертывания крови. Ниже представленный основные из них:
Такие же соединения открыты и в других клетках крови: эритроцитах и лейкоцитах. При гемотрансфузии (переливании крови) с несовместимой группой происходит массивное разрушение этих клеток и тромбоцитарные факторы свертывания в большом количестве выходят наружу, что приводит к активному образованию многочисленных тромбов. Этот состояние получило названия синдрома диссеминированного внутрисосудистого свертывания крови (ДВС-синдром).
Разновидности тромбов
Тромбы бывают четырёх типов.
- Белый. Основа сгустка — фибрин, тромбоциты и лейкоциты. Красных телец в сгустке минимум. Формируется преимущественно в артериях.
- Красный. Состав тромба — красные компоненты крови, фибрин и тромбоциты. Формируются в венах.
- Смешанного типа. Наиболее распространённая форма тромба, при которой в составе присутствуют приблизительно в равных пропорциях компоненты из первых двух типов. Формирование возможно в венах, сердце и аневризме аорты.
- Гиалиновый. В составе сгустка присутствуют гиализированные эритроциты и белки плазмы крови. Фибрина в составе практически нет. Образуются сгустки в капиллярах.
То, какой тромб образуется, зависит от типа повреждённого сосуда.
Виды коагуляционного гемостаза
Существует два механизма коагуляции: внешний и внутренний. Для активации внешнего необходим тканевой фактор. Эти два механизма сходятся в один при образовании X фактора свертывания, необходимого для образования тромбина, чтобы тот, в свою очередь, превратил фибриноген в фибрин.
Каскад этих реакций тормозит антитромбин III, который способен связать все факторы, кроме VIII. Также на процессы коагуляции влияет система протеин С — протеин S, которые угнетают активность V и VIII факторов.
Тромбоцитарные факторы свертывания
Все они находятся внутри тромбоцитов, или кровяных пластинок, задача которых — заниматься гемостазом, или всеми процессами, связанными со свертыванием крови. Тромбоциты также могут быть активными или не активными. В крови они чаще всего находятся вблизи сосудистой стенки, и редко бывают по центру кровотока. Это понятно, поскольку их задача — контролировать целостность сосудистой стенки, и сразу же включаться в процесс свёртывания, если обнаружена угроза ее повреждения.
Мы не будем подробно перечислять все 11 факторов, скажем только, что среди них есть несколько, идентичных плазменным. Например, есть тромбоцитарный аналог фибрина, или проакцелерина. Когда тромбоциты активируются, то тогда они, в свою очередь, кроме этих 11 факторов, начинают выделять множество белковых веществ, ионов, ферментов. Таких веществ сейчас известно более двух десятков, в их числе — тромбоцитарный фибронектин, гепариназа, активатор плазминогена, и даже серотонин. На соответствующих ресурсах можно тщательно изучить таблицу факторов свертывания тромбоцитарного ряда. Как же организована сложная, многократно продублированная система гемостаза?
Два пути свертывания крови, или «как это все работает»?
Оказывается, в организме человека нет единого пути гемостаза. Условно есть две разновидности свертывания крови:
Первый путь называется внешним, когда имеется какой-либо повреждающий фактор извне, и он травмирует сосуд.
Это любая открытая рана, травматическое повреждение. В данном случае тромбин образуется с целью закупорки сосуда и прекращения кровотечения;
Наряду с внешним путем существует и более загадочный и менее изученный внутренний путь образования того же самого тромбина, когда не происходит никакой травмы, сосудистая стенка не нарушает свою целостность, и отсутствуют те факторы свертывания, источником которых она является.
Этот внутренний путь может реализоваться по очень большому количеству причин, в числе которых самые разные заболевания и патологические состояния. И тот, и другой путь объединяет наличие в каскадах этих реакций ионов кальция и особых фосфолипидных структур.
Для нормального, внешнего пути, источником фосфолипидов является тканевой тромбопластин. Он всегда находится в разрушающихся от травмы тканях. Когда он смешивается с кровью, то начинает запускаться каскад внешнего пути гемостаза. Для того чтобы внешний гемостаз прошёл правильно, необходимо участие VII, IX, X, и II, плазменных факторов свертывания, о которых было сказано выше.
Если говорить о внутреннем пути гемостаза, то здесь уже не будет тканевого тромбопластина в качестве источника фосфолипидов, поскольку ткани не разрушаются. Тогда донорами этих фосфолипидов становятся кровяные пластинки — тромбоциты, и клетки эндотелия сосудов. Здесь свои активаторы, а именно — факторы XI и XII. В роли поврежденных и разрушенных тканей здесь выступают их аналоги, и организм, не в состоянии распознать, где истинное разрушение ткани, а где ложное — запускает внутренний каскад гемостаза обходными путями. Какие же это структуры, которые имитируют разрушение тканей и сосудов?
Это могут быть различные чужеродные поверхности, например, клапаны сердца. Весьма часто это бывают циркулирующие иммунные комплексы, которые образуются в избытке при заболеваниях соединительной ткани, и при так называемых аутоиммунных болезнях. Примером таких заболеваний может служить, например, системная красная волчанка, ревматоидный артрит, системные васкулиты. Именно для последней группы заболеваний наиболее характерно нарушение гемостаза, и склонность к тромбозам вследствие такого «обмана» тромбоцитов.
Кроме этого, запятая активатором процессов свертывания могут быть антифосфолипидные антитела, или разные токсины. И внешний путь, и внутренне путь начинаются по-разному, но затем они оба объединяются в общий поток реакций, которые катализируется факторами свертывания крови V и VIII. Результатом же и в том и в другом случае будет являться трансформация протромбина в тромбин, и полимеризация фибриногена в фибрин.
Не следует забывать, что тромбоциты, которые находятся вблизи эндотелия, или внутренней оболочки сосудов, могут не только начать активироваться при повреждении, или при разрыве сосудистой стенки. В некоторых случаях эндотелий сосудов может быть целым, но он значительно изменён. Это может возникать при воспалении, например, при тех же самых системных васкулитах. В таком случае нормальный сосуд, в котором кровь текла безо всяких проблем, превращается в очаг прогрессирующего тромбообразования. Несмотря на то, что в крови количество факторов свертывания существует с большим запасом, этот запас постепенно может истощаться. Но эти вопросы уже выходят далеко за рамки нашей темы, связанные с обзором системы свертывания.
Фазы свертывания крови
Для полной остановки кровотечения должны пройти три последовательные фазы.
Наиболее продолжительной является первая фаза. Наибольшее количество процессов происходит именно на данном этапе.
Для начала этой фазы должен образоваться активный комплекс протромбиназы, который, в свою очередь, сделает активным протромбин. Образуется два вида данного вещества: кровяная и тканевая протромбиназы.
Для образования первой необходима активация фактора Хагемана, которая происходит вследствие контакта с волокнами поврежденной сосудистой стенки. Также для функционирования XII фактора необходимы высокомолекулярный кининоген и калликреин. Их не включают в основную классификацию факторов свертывания крови, однако в некоторых источниках допускается их обозначение цифрами XV и XIV соответственно. Далее фактор Хагемана приводит в активное состояние XI фактор Розенталя. Это приводит к активации сначала IX, а после и VIII факторов. Антигемофильный глобулин А необходим для того чтобы X фактор стал активным, после чего он связывается с ионами кальция и V фактором. Таким образом, синтезируется кровяная протромбиназа. Все эти реакции происходят на матрице тромбоцитарного тромбопластина (ПФ-3). Этот процесс более длительный, его продолжительность составляет до 10 минут.
Образование тканевой протромбиназы происходит более быстро и легко. Сначала активируется тканевой тромбопластин, который появляется в крови после повреждения сосудистой стенки. Он объединяется с VII фактором и ионами кальция, активируя, таким образом, X фактор Стюарта-Прауэра. Последний, в свою очередь, взаимодействует с фосфолипидами тканей и проакцелерином, что приводит к выработке тканевой протрмбиназы. Этот механизм происходит намного быстрее — до 10 секунд.
Гемостаз
1. Понятие о свертывающей системе крови
2. Клеточные факторы свертывания крови.
3. Тромбоцитарно-сосудистый механизм.
4. Коагуляционный механизм.
5. Механизмы и факторы поддержания крови в жидком состоянии.
6. Лабораторные показатели свертывания крови.
Гемостаз (свертывающая система крови) — это сложная система гомеостаза, которая с одной стороны поддер — живает кровь в жидком состоянии, обеспечивая нормальное кровоснабжение органов и тканей, а с другой стороны — останавливает кровотечение и предупреждает потерю крови из организма за счет поддержания структурной целостности стенок кровеносных сосудов и быстрого тромбообразования при их повреждении. Значение этой системы в том, что она препятствует потере крови из циркуляторного русла и тем самым обеспечивает нормальное кровоснабжение органов и тканей.
Функциональная система гемостаза:
— Регулирующий аппарат: продолговатый мозг, гипоталамус, кора головного мозга;
— Рабочие органы системы: легкие: фибринолизин, антитромбопластин; тучные клетки: антитромбин; почки: фибринолизин; печень: прокоагулянты;
— Связующее звено: XII-фактор, параметаболиты = воспаление;
Реализуется гемостаз 3-мя взаимодействующими между собой структурными компонентами:
1. Стенками кровеносных сосудов (в первую очередь их интимой (tunica intima)),
2. Клетками крови, 3-х плазменными ферментными системами (свертывающей, фибринолитической (плазминовой), калликреинкининовой и др.).
Вся эта система подчиняется нейрогуморальной регуляции. В ней четко функционируют механизмы положительной и отрицательной обратной связи и поэтому образующийся в норме сгусток крови затем быстро растворяется. Особенно тесно взаимодействуют между собой внутренная оболочка кровеносных сосудов и тромбоциты и поэтому они объединяются в общий механизм — тромбоцитарно-сосудистый. Его также можно назвать первичным, т.к. именно микрососудам (диаметром до 100 мкм) и тромбоцитам принадлежит ведущая роль в остановке кровотечений в микроциркуляторном русле. Формирование фибриновых (коагуляционных) сгустков происходит несколько позднее, обеспечивает большую плотность и лучшее закрепление тромбов.
В такой последовательности мы и будем сейчас их разбирать.
Факторы, обеспечивающие тромбоцитарно-сосудистый гемостаз:
Для гемостаза особенно важны следующие функции тромбоцитов:
1. Ангиотрофическая — способность поддерживать нормальную структуру и функцию микрососудов, их устойчивость к повреждающим воздействиям, непроницаемость по отношению к эритроцитам;
2. Способность поддерживать спазм поврежденных сосудов путем секреции (высвобождения) вазоактивных веществ — адреналина, норадреналина, серотонина;
3. Способность закупоривать поврежденные сосуды путем образования первичной тромбоцитарной пробки (тромба) — процесс, зависящий от способности тромбоцитов приклеиваться к субэндотелию (адгезия), способности склеиваться друг с другом и образовывать комья из набухших тормбоцитов (агрегация),
4. Образовывать, накапливать и секретировать при активации вещества, стимулирующие адгезию и агрегацию и свертывание крови.
Тромбоцитарные факторы свертывания – из них наиболее важен мембранный фосфолипидный фактор 3, который служит матрицей для взаимодействия плазменных факторов гемокоагуляции и образования их активных комплексов.По своим свойствам этот компонент идентичен кефалину и мембранному фактору эритроцитов — эритроцитину.
Также важен 6-й фактор тромбоцитов — ретрактозим, необходимый для сокращения и уплотнения сгустка фибрина. В тромбоцитах имеются активаторы полимеризации мономеров фибрина, фактор V, а на поверхности и в их каналах концентрируются многие плазменные факторы свертывания и фибринолиза, и поэтому в гемостатической пробке создается их высокая концентрация (протромбин, тромбопластин, Ac-глобулин, конвертин, факторы II, III, V, VIII, IX, X, XI, XII, плазминоген и др. Поэтому тромбоциты наиболее существенно влияют на интенсивность и скорость локального свертывания в зоне тромбообразования, а не на процесс свертывания крови вообще.
Факторы эритроцитов, способствующие свертыванию крови:
1. Тромбопластический (эритроцитин — термостабильный фосфолипид,соответствующий 3-му фактору тромбоцитов).
2. Антигепариновый фактор.
3. Ac-глобулин.
4. Фактор, способствующий переходу фибриногена в фибрин.
5. Фибринстабилизирующий фактор.
6. Эритроциты усиливают адгезию и агрегацию тромбоцитов, выделяя АДФ.
7. Эритроциты адсорбируют гепарин и гепариноподобные вещества, доставляя их к почкам.
8. Эритроциты захватывают урокиназу и снижают фибринолиз.
Однако в эритроцитах есть факторы, препятствующие свертыванию крови:
1. Антитромбопластический фактор.
2. Антитромбины.
3. В эритроцитах имеются вещества, способствующие растворению кровяного сгустка – это, например, эритрокиназа. Если формирование кровяного сгустка сопровождается гемолизом, то освободившиеся проактиватор и активатор плазминогена способствуют быстрому разжижению крови. Т.о., разрушенные эритроциты в основном стимулируют фибринолиз, зато интактные препятствуют ему. Т.е. в естественых условиях включение эритроцитов в сгусток крови делает его более стойким к плазмину.
В лейкоцитах имеется тромбопластиночный фактор, напоминающий 3-й фактор тромбоцитов, антигепариновый фактор, АГГ, XII. Лейкоциты способны агрегировать и адгезировать к раневой поверхности, особенно под влиянием АДФ, усиливая в начале травмы формирование фибринового сгустка. При ряде патологических состояний из лейкоцитов выделяется прокоагулянт (тромбопластин) и развивается гиперкоагуляция — ДВС.
С другой стороны,на более поздних этапах повреждения они препятствуют адгезии тромбоцитов,способствуя движению крови и питанию травмированных участков. В базофилах содержится гепарин, а в нейтрофилах-антикоагулянт антитромбинного и антитромбопластического действия. Гранулоциты поддерживают кровь в жидком состоянии, выделяя гепарин, плазминоген, проактиватор и активаторы фибринолиза.
Факторы сосудистой стенки, способствующие свертывания крови:
1. Тромбопластин — наибольшим тромбопластическим действием обладают экстракты из внутреннего слоя сосуда, а эпителиальные клетки капилляров — наименьшим. Это имеет большое биологическое значение, т.к. для гемостаза в капиллярах при медленном кровотоке большее значение должна иметь внутренняя система гемостаза. В крупных артериях травма способствует активации внешнего механизма свертывания и остановке кровотечения. При атеросклерозе и с возрастом содержание тромбопластина в стенке сосуда снижается.
2. В стенке сосуда находится антигепариновый фактор — соединение,связывающее гепарин и тем самым ускоряющее свертывание крови. Фактор находится во всех слоях аорты, коронарных артериях, воротной и полых вен, различных тканях сердца. С возрастом его концентрация меняется незначительно и его роль, по-видимому,заключается в нейтрализации антикоагулянтов при повреждении тканей.
3. В сосудах имеется соединение, напоминающее конвертин, и вероятно, оно участвует в образовании протромбиназы.
4. В различных тканях (мозге,почках,легких,мышцах и др.) имеется фибринстабилизирующий фактор. Он имеется и в сосудах.
Эндотелий сосудов обладает высокой тромборезистентностью и играет большую роль в сохранении жидкого состояния циркулирующей крови за счет следующих его особенностей:
1. Эндотелий способен образовывать и выделять в кровь мощный ингибитор агрегации тромбоцитов — простациклин.
2. Эндотелий продуцирует тканевой активатор фибринолизина.
3. Эндотелий не способен к контактной активации св.системы крови.
4. Эндотелий создает антикоагулянтный потенциал на границе кровь/ткань путем фиксации комплекса гепарин-антитромбин-III.
5. Эндотелий способен удалять из кровотока активированные факторы свертывания крови.
Стенки сосудов способны противостоять не только давлению крови, но и умеренным внешним травмирующим воздействиям, препятствуя развитию геморрагий. Это зависит как от полноценности эндотелия, так и от особенностей строения субэндотелиального слоя — степени развития и качества коллагена и микрофибрилл, соотношения коллагеновых и эластических волокон,структуры базальной мембраны и т.д.
Во многом эти свойства зависят от тромбоцитов — их количества и качественных особенностей и поэтому при недостаточном содержании тромбоцитов или их качественных дефектах усиливается как диапедезная кровоточивость (при отсутствии механического повреждения сосудов), так и ломкость микрососудов: легко возникают петехии и синяки, становятся положительными пробы на ломкость капилляров (пр.щипка, манжеточная и др.).
При повреждении сосудов и оголении субэндотелия происходит активация гемостаза различными путями:
1. Выделение в кровь тканевого тромбопластина (фактор III, апопротеин III) и других активаторов свертывания, а также стимуляторов тромбоцитов — адреналина, норадреналина,АДФ,
2. Контактная активация коллагеном и др. компонентами субэндотелия тромбоцитов (адгезия) и свертывания крови (активация XII фактора),
3. Продукция плазменных кофакторов адгезии и агрегации тромбоцитов (фактор Виллебранда и др).
Таким образом, сосудистая стенка самым тесным образом взаимодействует со всеми звеньями гемостаза,особенно с тромбоцитами.
Тромбоцитарно-сосудистый гемостаз.
Основная роль в осуществлении первичного гемостаза принадлежит тромбоцитам. Вследствие повреждения кровеносных сосудов тромбоциты контактируют с субэндотелием — в основном, с главным стимулятором адгезии — коллагеном — набухают,образуют отростки и приклеиваются. Длительность этой фазы 1-3 секунды. Для этого необходимы ионы Ca и синтезируемый в эндотелии белок — фактор Виллебранда (VIII, ФВ), а в тромбоцитах — взаимодействующий с этим фактором мембранный гликопротеин Ib (ГП-Ib), что при его отсутствии приводит к болезни Бернара-Сулье.
Вслед за адгезией происходит быстрая агрегация тромбоцитов на участок повреждения – II фаза (десятки секунд), что приводит к быстрому росту тромба. Первичный стимул к агрегации дают коллаген и в еще большей степени АДФ, катехоламины и серотонин, выделяющиеся из сосудистой стенки, из гемолизирующихся в зоне повреждения тромбоцитов и уже адгезировавшихся тромбоцитов.
Из тромбоцитов,подвергшихся адгезии и агрегации, активно секретируются гранулы с веществами, усиливающими процесс агрегации и формирующие ее вторую волну: адреналин, норадреналин, серотонин,антигепариновый фактор 4. Позднее секретируются гранулы,содержащие лизосомальные ферменты.
В итоге взаимодействия тромбоцитарных и плазменных факторов в зоне гемостаза образуется тромбин, малые дозы которого резко усиливают и завершают процесс агрегации и одновременно запускают свертывание крови,в следствие чего тромбоцитарный сгусток приобретает большую плотность и подвергается ретракции — III фаза — вязкий метаморфоз.
После агрегации тромбоцитов и образования фибрина, под влиянием ретрактозима сокращается особый контрактильный белок тромбоцитов — тромбостенин, что ведет к сближению тромбоцитов, нитей фибрина. Для ретракции требуется тромбин, способствующий вязкому метаморфозу.
В регуляции тромбоцитарного гемостаза важную роль играют производные арахидоновой кислоты, освобождаемой из мембранных фосфолипидов тромбоцитов и сосудистой стенки вследствии активации фосфолипаз. Под влиянием циклооксигеназы образуются простагландины,из них в тромбоцитах под влиянием тромбоксан-синтетазы образуется чрезвычайно мощный агрегирующий агент — тромбоксан-А2.
Продолжительность жизни тромбоксана, простациклина и других простагландинов несколько минут, но их значение в регуляции и патологии гемостаза весьма велико. Этот механизм является триггерным в развитии ААФТ (адгезивно — агрегационной функции тромбоцитов). Для осуществления ААФТ необходим ряд плазменных кофакторов агрегации — ионы кальция и магния, фибриноген, альбумин и два белковых кофактора, обозначаемых в литературе как агрексоны A и B, фосфолипидный кофактор и др.
В то же время парапротеины, криоглобулины и продукты фибринолиза ингибируют агрегацию тромбоцитов.
Для осуществления агрегационной функции очень важны мембранные гликопротеины тромбоцитов, взаимодействующие с агрегирующими агентами:
1) гликопротеин 1, состоящий из двух субъединиц – 1a и 1b. Первая являтся рецептором фактора Виллебранда и необходима для адгезии,вторая — для тромбин-агрегации (их уменьшение ведет к болезни Виллебранда, Бернара — Сулье;
2) гликопротеин 2 (также из двух субъединиц) необходим для всех видов агрегации (при его дефиците развивается тромбоцитоастения Гланцмана);
3) гликопротеин 3, один из компонентов которого соединяется с Hb и кальцием и необходим для большинства видов агрегации и ретракции сгустка.
Коагуляционный гемостаз.
Свертывание крови — сложный многоэтапный процесс, в котором участвует ряд белков-протеаз, неферментные белки-акцелераторы, обеспечивающие взаимодействие факторов свертывания на фосфолипидных матрицах (тромбоцитарный фактор 3, микромембраны других клеток), ионы кальция.
Его условно делят на 3 фазы:
1 — многоступенчатое образование тромбопластина;
2 — образование тромбина;
3 — конечный этап, где под влиянием тромбина фибриноген вначале превращается в мономеры фибрина, а затем в его полимер, стабилизирующийся активированным фактором XIII.
Номенклатура. По международной номенклатуре все плазменные факторы свертывания обозначаются римскими цифрами в порядке открытия факторов (реже — по функции,фамилиям авторов или больных).
Плазменные факторы:
– фибриноген – эуглобин, молекулярная масса 400000-500000 Да, образуется во всех органах и тканях, имеющих систему фагоцитирующих мононуклеаров (СФМН) (большая часть в печени), находится в плазме, лимфе, КМ, транс- и экссудате (содержание в плазме 200-400 мг%, уменьшается при болезнях печени, менструациях, увеличивается при беременности, инфекционных заболеваниях, воспалительных процессах, в послеоперационный период). Является неактивной формой белка фибрина, переходит в фибрин под влиянием тромбина.
– протромбин (тромбоген) – эуглобин (гликопротеид), образуется в СФМН (больше всего в печени, меньше в других органах) при участии витамина K, преходит в активную форму – тромбин.
– тканевой тромбопластин,
– ионы Ca2+,
– плазменный Ac-глобулин, проакцелерин, лабильный фактор,
– сывороточный Ac-глобулин, акцелерин, активная форма V фактора,
– проконвертин, стабильный фактор, образуется при участии витамина K в печени,
– антигемофильный глобулин A (АГГA),
— плазменный компонент тромбопластина, антигемофильный глобулин B, фактор Кристмаса, образуется при участии витамина K.
– антигемофильный глобулин C, фактор Стюарта-Прауэра, протромбиназа, образуется при участии витамина K.
— плазменный предшественник тромбопластина (ППТ), фактор Розенталя, образуется при участии витамина K.
– фактор контакта, фактор Хагемана – после активации остается на поверхности поврежденного сосуда, что препятствует генерализации процесса свертывания крови; активирует калликреиновую систему, систему комплемента и фибринолиз.
— фибринстабилизирующий фактор (фибриназа, фибринолигаза, трансглутаминаза), образуется в печени.
– калликреин.
— кининоген.
Для обозначения активированного фактора к этим цифрам добавляется буква «a» или «f», если активным действующим началом становится один из фрагментов фактора.
По современной каскадно-комплексной теории свертывания крови активация протромбина (фактора II) является результатом многоступенчатого ферментного процесса, в котором последовательно активируются и взаимодействуют между собой различные факторы свертывания.Из них факторы III, VII, IX, X, XI и XII,а также прекалликреин являются ферментами-протеазами, а факторы VIII и V — неферментными акцелераторами процесса,ускоряющими взаимодействие и активацию ферментных факторов во много тысяч раз.
Имеются два основных механизма запуска процесса свертывания — внешний и внутренний. Во внешнем механизме свертывание крови стимулируется поступлением в плазму тканевого тромбопластина (фактора III или комплекса фосфолипид-апопротеин III). Во внутреннем механизме свертывание крови происходит без участия тканевого тромбопластина. Пусковым фактором здесь служит фактор XII (Хагемана), активация которого происходит либо вследствие контакта с чужеродной поверхностью (стеклом, металлом) или за счет его ферментного расщепления калликреином, плазмином и др. протеазами, либо при контакте с субэндотелием (коллагеном) и другими компонентами соединительной ткани при травмах, васкулитах, атеросклерозе.
Схема каскадно-комплексного механизма свертывания крови:
Механизм трансформации фибриногена в фибрин.
Сущность этого этапа состоит в том, что протеолитический фермент тромбин (образованный из протромбина) отщепляет от молекулы фибриногена два пептида А и два пептида В. В результате образуются мономеры фибрина, у каждого из которых имется 4 свободных связи. Происходит соединение этими связями друг с другом вначале парами (димеры), а затем и в полимер (соединяясь по типу конец в конец и бок к боку) и формируются волокна фибрина.
Этот фибрин растворим (в 5-7 М мочевине и 2% монохлоруксусной кислоте) и обозначается как фибрин S (soluble). Под влиянием фактора XIIIа (который также активируется тромбином в присутствии ионов Са2+) в фибрине образуются дополнительные дисульфидные связи между Y – и a-цепями. Образуется нерастворимый в мочевине фибрин I (insoluble).
Физиологические антикоагулянты — необходимы для поддержания крови в жидком состоянии и для ограничения процесса тромбообразования.
Они подразделяются на две основные группы:
1. Первичные, или самостоятельно синтезируемые и постоянно содержащиеся в крови,
2. Вторичные, образующиеся в процессе протеолиза при свертывании крови и фибринолизе.
Среди первичных наиболее важны следующие белки-ингибиторы:
Гепарин — естественный антикоагулянт (вместе с фибринолизином является частью физиологической антисвертывающей системы крови). Вырабатывается в базофилах и тучных клетках. Гепарин влияет непосредственно на факторы свертывания крови, блокируя или снижая их активность. При внутривенном введении эффект наступает практически мгновенно и продолжается 4-6 часов. Разрушается гепарин в тканях при участии гепариназы (образуется урогепарин, который выводится через почки).Гепарин обладает антитромбопластиновым, антипротромбиновым и антитромбиновым влиянием, задерживает переход фибриногена в фибрин, повышает фибринолиз, в больших дозах тормозит агрегацию и адгезию тромбоцитов, повышает проницаемость сосудов.
Антитромбин III — универсальный ингибитор почти всех ферментных факторов свертывания, в первую очередь тромбина — IIa и Xa. На его долю падает более 75% всей антикоагулянтной активности плазмы. Он является основным плазменным кофактором гепарина и если антитромбина III в крови мало, то вводить больному гепарин для лечения тромбоза нет смысла. При наследственном или приобретенном снижении антитромбина III возникает тяжелое тромбофилическое состояние с рецидивирующими тромбозами магистральных вен конечностей и внутрених органов, тромбоэмболиями легочной артерии, инфарктами органов.
Вторичные физиологические антикоагулянты — образуются в процессе свертывания крови и фибринолиза в результате дальнейшей ферментной деградации ряда факторов свертывания. После начальной активации они утрачивают способность участвовать в гемостазе и часто приобретают свойства антикоагулянтов. Так, фибрин адсорбирует и инактивирует большие количества тромбина (и обозначается как антитромбин I). Продукты ферментного расщепления фибриногена/фибрина плазмином (фибринолизином) ингибируют как агрегацию тромбоцитов, так и самосборку фибрин-мономеров — т.е. образование фибрина. Адреналин в комплексе с фибриногеном и гепарином превращается из стимулятора агрегации тромбоцитов и свертывания крови в фактор, препятствующий гемокоагуляции и в активатор неферментного фибринолиза.
Фибринолиз — ферментная система (вызывающая асимметричное расщепление фибрина/фибриногена на все более мелкие фрагменты) называется фибринолитической или плазминовой. Главным компонентом этой системы является фермент плазмин (фибринолизин), содержащийся в плазме в виде профермента — плазминогена. Активный плазмин быстро блокируется антиплазминогенами и выводится из кровотока. При введении стрептокиназы или урокиназы уровень плазминогена в крови очень быстро и глубоко снижается в связи с переходом в активный плазмин, а затем в течение 18-28 часов восстанавливается. В организме активация фибринолиза (как и активация свертывания) может быть как по внешнему, так и по внутреннему пути.
Внутренная активация фибринолиза (как и свертывания) обусловлена комплексом XIIa или XIIf c калликреином (XIV) и высокомолекулярным кининогеном (XV).
Внешняя активация осуществляется в основном белковым активатором тканевого типа, синтезируемым в сосудистом эндотелии. Его интенсивный выброс происходит при всех видах закупорки сосудов или сжатии их, под влиянием вазоактивных веществ и лекарственных препаратов.
Механизмы и факторы поддержания крови в жидком состоянии.
Поддержание крови в жидком состоянии осуществляется благодаря наличию антикоагулянтов, активность которых должна быть выше, чем коагулянтов. С учетом множества факторов свертывания имеется мощная система антикоагулянтов. В ней есть антитромбопластины, антитромбины, ферменты, препятствующие переходу фибриногена в фибрин. При попадании тромбина в кровь он раздражает хеморецепторы сосудистой стенки. Отсюда раздражение рефлекторным путем передается в продолговатый мозг и в итоге происходит выброс из сосудистой стенки гепарина и гепариноподобных антикоагулянтов, которые задерживают образование фибрина и перевод его в фибриноген (шаровидной формы). За открытие этого механизма академик Б.А. Кудряшов получил Ленинскую премию.
Лабораторные показатели для определения опасности кровотечения или тромбоза:
I. Интегральные показатели, дающие суммарное представлениме о системе свертывания.
а) общие показатели тромбоцитарно-сосудистого гемостаза,
1. Механическая устойчивость капилляров (проба щипка, количество петехий),
2. Длительность кровотечения из прокола пальца или мочки уха,
3. Показатели агрегации тромбоцитов.
б) показатели коагуляционного гемостаза: время свертывания крови (4-8 мин), изменяется при грубых нарушениях: удлиняется при гемофилии, укорачивается при тромбозах.
II. Пробы, характеризующие отдельные этапы коагуляционного или тромбоцитарно-сосудистого гемостаза.
Определение отдельных фаз гемостаза:
I фаза:
а) время рекальцификации плазмы 1.5 — 2 мин, на его основе разработан
б) аутокоагуляционный тест — из крови больного готовят гемолизат в гипотоническом растворе Са2+ и определяют его тромбопластическую активность по отношению к плазме больного или донора, исследуют динамику свертывания плазмы.
в) толерантность плазмы к гепарину.
г) тромбопластиновый тест, показывающий активность тромбопластина и если при аутокоагуляционном тесте определили нормальные показатели II и III фаз свертывания, то изменения теста будут связаны только с патологией I фазы.
II фаза:
а) протромбиновый тест — к цитратной плазме добавляют тканевой (уже активный) тромбопластин, который актививрует II и I факторы. Определяют протромбиновое время больного (в норме 13-15 сек). Но поскольку тромбопластин при хранении разрушается, то определяют протромбиновый индекс при одновременном определении — протромбиновое время здорового · 100 = %. Норма 80-100%, меньше протромбиновое время больного — гипокоагуляция, больше — гиперкоагуляция. И поскольку факторы V, VII, VIII и X синтезируются в печени, то тест характеризует ее белково-образовательую функцию.
б) тромбиновый тест — при добавлении к плазме тромбина — удлинение времени свидетельствует об увеличении антикоагулянтов или уменьшении фибриногена.
III фаза:
а) определение количества фибриногена,
б) определение тромботеста.
III. Активность отдельных факторов свертывания или антикоагулянтов.
1: определение антикоагулянтов:
а) антитромбиновой активности по тромбиновому тесту 20-32 сек,
б) определение свободного гепарина по ускорению тромбинового времени после связывания гепарина и ему подобных антикоагулянтов протаминсульфатом 5-10 сек,
в) определение фибринолитической активности плазмы по времени растворения стандартного сгустка фибрина: за час растворяется 10-25 %,
2: а) определение количества тромбоцитов 200-400·109/л,
б) определение индекса ретракции кровяного сгустка (0.3-0.5/час).
в) скорость адгезии определяется по тому, сколько тромбоцитов останется во взвеси после контакта со стеклянными бусами или стеклом — снижение адгезии — склонность к кровоточивости, повышение — к тромбозам,
г) агрегация тромбоцитов: спонтанная (естественная) и индуцированная. Определяют по изменению оптической плотности взвеси тромбоцитов. Чем выше агрегация, тем больше изменяется оптическая плотность. Норма — 18-20%.
Вторая и третья фазы
Вторая фаза начинается с превращения протромбина в активный тромбин при помощи функционирования протромбиназы. Для этого этапа необходимо действие таких плазменных факторов свертывания, как IV, V, X. Этап заканчивается образованием тромбина и протекает за несколько секунд.
Третья фаза заключается в превращении фибриногена в нерастворимый фибрин. Сначала образуется фибрин-мономер, что обеспечивается действием тромбина. Далее он превращается в фибрин-полимер, который уже является нерастворимым соединением. Это происходит под воздействием фибринстабилизирующего фактора. После формирования фибринового сгустка на него осаживаются форменные элементы крови, что приводит к образованию тромба.
После под влиянием ионов кальция и тромбостенина (белка, синтезируемого тромбоцитом) происходит ретракция сгустка. Во время ретрации тромб теряет до половины своего первоначального размера, так как отжимается сыворотка крови (плазма без фибриногена). Данный процесс занимает несколько часов.
Что означает показатель «тромбоциты» в анализе крови?
Тромбоциты – небольшие клетки крови размером 2–4 мкм. Их название произошло от греческих слов «сгусток» и «клетка», что довольно хорошо описывает их способность к формированию тромбов. Эти элементы крови обладают сферической формой, не имеют ядра и цвета, образуются в клетках красного костного мозга. Основная функция тромбоцитов – поддержание работы кровеносных сосудов. В организме человека тромбоциты «ответственны» за следующие процессы:
- Первичное (физическое) закупоривание сосудов в местах их повреждения для предотвращения кровопотери – форпост и первая линия обороны, организуемая тромбоцитами в деле сохранения жидкого состояния крови в пределах вен, артерий, капилляров. Достигается это в процессе многочисленных взаимодействий компонентов стенки сосуда, клеток крови и плазматических факторов свертывания, содержащихся во внешнем слое тромбоцита.
- Плазменное свертывание (формирование постоянной тромбоцитарной пробки) начинается в результате выделения фосфолипидов (гликопротеинов) из мембраны тромбоцита и а-гранул с 22 активными компонентами: высокомолекулярными белками, ионами кальция и низкомолекулярными органическими веществами – они запускают процесс свертываемости крови, являясь его факторами. Наряду с внутренними тромбоцитарными факторами свертываемости известно также 12 плазменных (содержащихся в плазме крови). Все они взаимосвязаны и образуют сложную последовательную цепочку, каскад биохимических реакций, приводящий к образованию плотного фибринового сгустка, его уплотнению, а после заживления раны – рассасыванию.
- Регенерация и ангиотрофическая функция . Отдавая часть своей поверхности на «заплатки», тромбоцит обеспечивает питание клеток сосудистой стенки (эндотелиоцитов), поддерживая структуры и функции микрокапилляров. Это происходит за счет поглощения тромбоцитов эндотелиоцитами. Разрушаясь, тромбоцит высвобождает другие «факторы» – факторы роста: VEGF, EGF, PDGF, TGF-β, FGF и прочие, отвечающие за восстановление и деление клеток. Ежедневно эндотелий (внутренний защитный слой сосудов, состоящий из эндотелиоцитов) поглощает примерно 35 г/л тромбоцитов.
Фибринолиз
Чтобы образовавшийся тромб полностью не закупорил просвет сосуда и не прекратил кровоснабжение соответствующих ему тканей, существует система фибринолиза. Она обеспечивает расщепление фибринового сгустка. Данный процесс происходит в то же время, что и уплотнение тромба, однако идет гораздо медленней.
Для осуществления фибринолиза необходимо действие специального вещества — плазмина. Он образуется в крови из плазминогена, который активируется благодаря наличию активаторов плазминогена. Одним из таких веществ является урокиназа. Изначально она тоже находится в неактивном состоянии, начиная функционировать под влиянием адреналина (гормона, выделяемого надпочечниками), лизокиназ.
Плазмин раскладывает фибрин на полипептиды, что приводит к растворению кровяного сгустка. Если механизмы фибринолиза по какой-либо причине нарушены, тромб замещается соединительной тканью. Он может внезапно оторваться от стенки сосуда и вызвать закупорку где-то в другом органе, что получило название тромбоэмболии.
Диагностика состояния гемостаза
Если у человека наблюдается синдром повышенной кровоточивости (сильное кровотечение при операционных вмешательствах, носовые, маточные кровотечения, беспричинное появление синяков), стоит заподозрить патологию свертывания крови. Для выявления причины нарушения свертывания целесообразно сдать общий анализ крови, коагулограмму, которая отобразит состояние коагуляционного гемостаза.
Также целесообразным является определение факторов свертывания, а именно VIII и IX фактора. Поскольку уменьшение концентрации именно этих соединений чаще всего приводит к нарушениям свертывания крови.
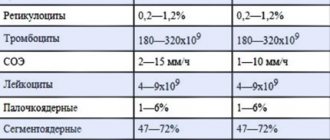
Основными показателями, характеризующими состояние свертывающей системы крови, являются:
Какие анализы могут помочь
Наконец, в заключение следует очень коротко рассказать, какие методы исследования могут оценить потенциал внутреннего и внешнего пути активация свертывающей системы. Из наиболее простых коагулологических тестов внутренний путь активации можно определить через АЧТВ (активированное частичное тромбопластиновое время). Стоимость проведения анализа в современных частных лабораториях примерно составляет 175 руб.
В норме у пациента это время колеблется от 25 до 37 секунд. И повышение продолжительности свёртывания крови, или замедление времени, говорит о различных типах гемофилии, болезнях соответствующих факторов, влияющих на свертываемость крови — Виллебранта или Хагемана. Также удлиняется время при лечении гепарином, а также при наличии антифосфолипидного синдрома.
Второй довольно простой «свертологический» анализ это — исследование протромбинового времени и МНО (международного нормализованного отношения). Стоимость этого исследования в лаборатории составляет около 270 рублей, и данный анализ является тестом на коагуляцию, который показывает, как сворачивается плазма пациента после добавления в нее особой смеси тромбопластина и кальция в качестве затравки. В норме протромбиновое время колеблется от 78 до 142%. Второе название этой исследования — протромбиновый индекс, и об этом существует отдельная статья. Если он выше этих значений, то у пациента высоко склонность к тромбозам, а если она понижена, — то это может говорить о плохо работающей печени, а дефиците витамина К.
Патология гемостаза
Наиболее частое заболевание, которое наблюдается при дефиците факторов свертывания, является гемофилия. Это наследственная патология, передающаяся вместе с Х-хромосомой. Болеют в основном мальчики, а девочки могут быть носителями заболевания. Это значит, что у девочек не возникает симптомов болезни, однако они могут передать ген гемофилии свои потомкам.
При дефиците VIII фактора свертывания развивается гемофилия А, при уменьшении количества IX — гемофилия В. Первый вариант протекает более тяжело и имеет менее благоприятный прогноз.
Клинически гемофилия проявляется повышенной кровопотерей после операционных вмешательств, косметологических процедур, частыми носовыми или маточными (у девочек) кровотечениями. Характерной особенность этой патологии гемостаза является накопление крови в суставах (гемартрозы), что проявляется их болезненностью, отечностью и покраснением.
Диагностика и лечение гемофилии
Диагностика заключается в определении активности факторов (значительно понижена), проведении коагулограммы (удлинение времени свертывания крови и АЧТВ, увеличение времени рекальцификации плазмы).
Лечение гемофилии заключается в пожизненной заместительной терапии факторами свертывания (VIII и IX). Также рекомендованы препараты, укрепляющие сосудистую стенку («Трентал»).
Таким образом, факторы свертывания крови занимают важное место в обеспечении нормального функционирования организма. Их активность обеспечивает слаженную работу всех внутренних органов благодаря доставке им кислорода и необходимых питательных веществ.